《浙江省蒼南縣高中化學(xué) 專題2 化學(xué)反應(yīng)與能量轉(zhuǎn)化 2.3.2 電能轉(zhuǎn)化為化學(xué)能(2)課件 蘇教版必修2》由會(huì)員分享��,可在線閱讀���,更多相關(guān)《浙江省蒼南縣高中化學(xué) 專題2 化學(xué)反應(yīng)與能量轉(zhuǎn)化 2.3.2 電能轉(zhuǎn)化為化學(xué)能(2)課件 蘇教版必修2(17頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索��。
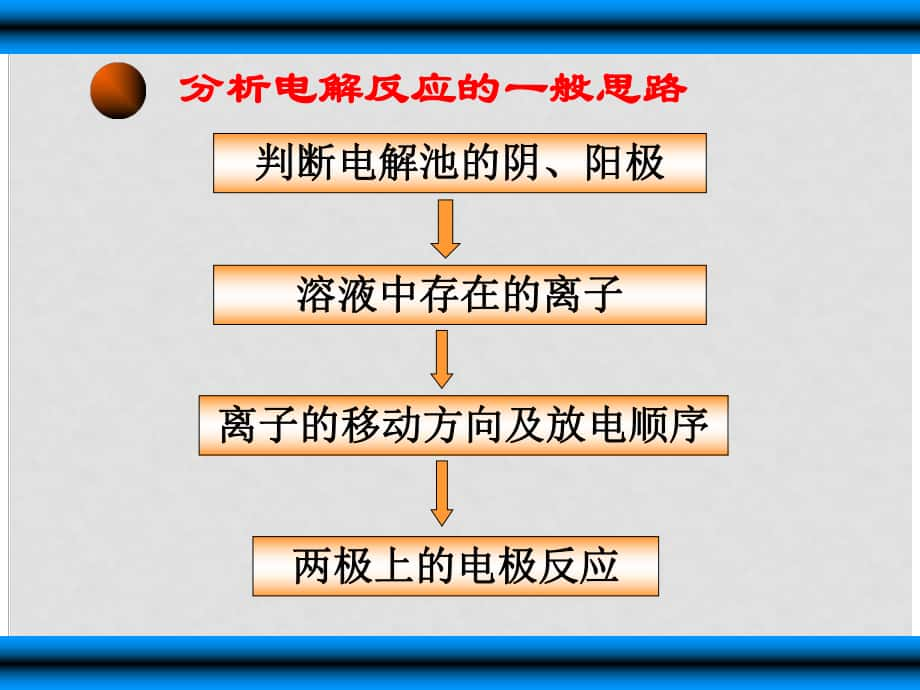
1���、分析電解反應(yīng)的一般思路分析電解反應(yīng)的一般思路溶液中存在的離子溶液中存在的離子兩極上的電極反應(yīng)兩極上的電極反應(yīng)離子的移動(dòng)方向及放電順序離子的移動(dòng)方向及放電順序判斷電解池的陰����、陽(yáng)極判斷電解池的陰����、陽(yáng)極二二. .電極產(chǎn)物的判斷及電極反應(yīng)的書寫電極產(chǎn)物的判斷及電極反應(yīng)的書寫 陽(yáng)極陽(yáng)極:先看電極后看溶液先看電極后看溶液 (1) (1) 活潑金屬電極活潑金屬電極: :金屬電極失電子(除金和鉑外金屬電極失電子(除金和鉑外) ) (2) (2) 惰性電極惰性電極: :溶液中陰離子失去電子溶液中陰離子失去電子, , 失電子能力為失電子能力為: : S2- I - Br - Cl - OH - 含氧酸根含氧酸根F
2����、- 陰極陰極: 溶液中陽(yáng)離子得電子溶液中陽(yáng)離子得電子,得電子能力為得電子能力為: Ag+ Fe3+ Cu2+ H+ (酸)(酸) Pb2+ Sn2+ Fe2+ Zn2+ H+ (水)(水) Al3+ Mg2+ 重點(diǎn)重點(diǎn)記記重點(diǎn)重點(diǎn)記記 (2)活潑金屬的冶煉)活潑金屬的冶煉鈉的制取鈉的制取鎂的制取鎂的制取鋁的制取鋁的制取總反應(yīng)式總反應(yīng)式 : 2NaCl 2Na+Cl2通電總反應(yīng)式總反應(yīng)式 : MgCl2 Mg+Cl2通電總反應(yīng)式總反應(yīng)式 : 2Al2O3 2Al+3O2通電(1)氯堿工業(yè))氯堿工業(yè)電解飽和食鹽水電解飽和食鹽水.wmv總反應(yīng)總反應(yīng):2NaCl+2H2O2NaOH+ Cl2 + H2
3、 電解三三. 電解原理的應(yīng)用電解原理的應(yīng)用(3)電鍍銅)電鍍銅 (1) 電鍍是利用電解原理在某些鍍件上鍍上一層其他金屬電鍍是利用電解原理在某些鍍件上鍍上一層其他金屬或合金的過(guò)程��,是電解的一個(gè)重要應(yīng)用��?��;蚝辖鸬倪^(guò)程��,是電解的一個(gè)重要應(yīng)用��。 (2) 電鍍池的形成條件電鍍池的形成條件 陰極:待鍍金屬制品陰極:待鍍金屬制品(鍍件鍍件) 陽(yáng)極:鍍層金屬陽(yáng)極:鍍層金屬 電鍍液:含有鍍層金屬陽(yáng)離子的可溶性鹽溶液電鍍液:含有鍍層金屬陽(yáng)離子的可溶性鹽溶液 鍍件鍍件 銅銅 氯化銅溶液氯化銅溶液實(shí)驗(yàn)現(xiàn)象實(shí)驗(yàn)現(xiàn)象陽(yáng)極:陽(yáng)極:陰極:陰極:銅變細(xì)變小銅變細(xì)變小有紅色固體產(chǎn)生有紅色固體產(chǎn)生電極反應(yīng)式電極反應(yīng)式Cu2e- C
4��、u2+Cu2+2e-Cu電鍍液的組成及酸堿性不會(huì)變化電鍍液的組成及酸堿性不會(huì)變化(4)銅的電解精煉)銅的電解精煉���、粗銅所含的雜質(zhì)��、粗銅所含的雜質(zhì)Zn���、Fe、Ni���、Ag����、Au等等+純銅純銅粗銅粗銅CuSO4溶液溶液���、粗銅的精煉����、粗銅的精煉 以粗銅為陽(yáng)極���,以純以粗銅為陽(yáng)極���,以純銅為陰極����,銅為陰極���, 以以CuSO4溶液溶液為電解液進(jìn)行電解為電解液進(jìn)行電解陽(yáng)極:陽(yáng)極: Zn 2eZn2+ Fe2eFe2+ Ni 2eNi2+ Cu2eCu2+ 陰極:陰極: Cu2+ +2eCu長(zhǎng)時(shí)間電解后必須補(bǔ)充或更換電解液長(zhǎng)時(shí)間電解后必須補(bǔ)充或更換電解液原電池原電池電解池電解池電鍍池電鍍池定義定義化學(xué)能轉(zhuǎn)變成電能的
5���、化學(xué)能轉(zhuǎn)變成電能的裝置。裝置���。將電能轉(zhuǎn)變成化學(xué)能將電能轉(zhuǎn)變成化學(xué)能的裝置。的裝置���。應(yīng)用電解原理在某些金屬應(yīng)用電解原理在某些金屬表面鍍上一層其它金屬的表面鍍上一層其它金屬的裝置����。裝置��。形成形成條件條件活動(dòng)性不同兩電極活動(dòng)性不同兩電極電解質(zhì)溶液電解質(zhì)溶液形成閉合回路形成閉合回路兩電極接直流電源兩電極接直流電源電極插入電解質(zhì)溶電極插入電解質(zhì)溶液液形成閉合回路形成閉合回路鍍層金屬接電源正極����,鍍層金屬接電源正極��,待鍍金屬接電源負(fù)極待鍍金屬接電源負(fù)極電鍍液須含有鍍層金屬電鍍液須含有鍍層金屬的離子的離子電極電極名稱名稱負(fù)極:較活潑金屬����;負(fù)極:較活潑金屬���;正極:較不活潑金屬正極:較不活潑金屬(或能導(dǎo)電的非金屬
6����、等或能導(dǎo)電的非金屬等)陽(yáng)極:電源正極相連陽(yáng)極:電源正極相連陰極:電源負(fù)極相連陰極:電源負(fù)極相連陽(yáng)極:鍍層金屬����;陽(yáng)極:鍍層金屬;陰極:鍍件陰極:鍍件電極電極反應(yīng)反應(yīng)負(fù)極:氧化反應(yīng)負(fù)極:氧化反應(yīng)正極:還原反應(yīng)正極:還原反應(yīng)陽(yáng)極:氧化反應(yīng)陽(yáng)極:氧化反應(yīng)陰極:還原反應(yīng)陰極:還原反應(yīng)陽(yáng)極:氧化反應(yīng)陽(yáng)極:氧化反應(yīng)陰極:還原反應(yīng)陰極:還原反應(yīng)要點(diǎn)一:原電池��、電解池���、電鍍池的比較要點(diǎn)一:原電池����、電解池���、電鍍池的比較電解電解Na2SO4溶液的分析溶液的分析陰極陰極陽(yáng)極陽(yáng)極氧氧氣氣氫氫氣氣陽(yáng)極陽(yáng)極: 4OH- 4e- = 2H2O+O2 實(shí)例實(shí)例電極反應(yīng)電極反應(yīng) 濃度濃度PH值值復(fù)原復(fù)原Na2SO4 陰極陰極:
7��、4H + 4e- = 2H2 變大變大不不變變 加加H2O2H2O = 2H2 +O2 通電通電如電解如電解H2SO4����、HNO3、NaOH���、Na2SO4等溶等溶液時(shí)其電極反應(yīng)式為:液時(shí)其電極反應(yīng)式為:陽(yáng)極陽(yáng)極 : 4OH4e2H2O +O2陰極陰極: 4H+ +4e2H2 總反應(yīng)總反應(yīng):2H2O O2 +2H2 電解 電解后溶液中電解后溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)增大溶質(zhì)的質(zhì)量分?jǐn)?shù)增大���,若要恢,若要恢復(fù)原來(lái)的濃度��,只需加入一定量的水即可��。復(fù)原來(lái)的濃度���,只需加入一定量的水即可。用惰性電極電解電解質(zhì)溶液規(guī)律用惰性電極電解電解質(zhì)溶液規(guī)律(1)電解水型:電解水型:如電解鹽酸如電解鹽酸���、CuCl2溶液等溶液等
8���、電解后溶液中電解后溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)減小溶質(zhì)的質(zhì)量分?jǐn)?shù)減小,若要,若要恢復(fù)原來(lái)的組成和濃度��,需加入一定量的溶質(zhì)恢復(fù)原來(lái)的組成和濃度���,需加入一定量的溶質(zhì)(通入一定量的通入一定量的HCl氣體氣體)陽(yáng)極陽(yáng)極: 2Cl 2eCl2陰極陰極: 2H+ +2e H2 總反應(yīng)總反應(yīng):2HCl Cl2 + H2 電解電解鹽酸電解鹽酸(2)電解本身:電解本身:電解電解CuSO4溶液的分析溶液的分析陰極陰極陽(yáng)極陽(yáng)極氧氧氣氣銅銅實(shí)例實(shí)例電極反應(yīng)電極反應(yīng) 濃度濃度PH值值復(fù)原復(fù)原CuSO4 2CuSO4+ 2H2O 2Cu +O2 + 2H2SO4電解陰極:陰極:Cu2+ 2e-=Cu減小減小 加加CuO陽(yáng)極陽(yáng)極:
9���、 4OH- 4e- = 2H2O+O2 減減小小如電解如電解CuSO4溶液、溶液���、AgNO3溶液等���。溶液等。陽(yáng)極陽(yáng)極 : 4OH4e2H2O +O2陰極陰極: 2Cu2+ +4e2Cu總反應(yīng)總反應(yīng): 2CuSO4 +2H2O 2Cu+O2 +2H2SO4 電解 電解后原溶液中電解后原溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)減小溶質(zhì)的質(zhì)量分?jǐn)?shù)減小��,若���,若要恢復(fù)原來(lái)的組成和濃度����,需加入一定量金屬要恢復(fù)原來(lái)的組成和濃度����,需加入一定量金屬氧化物。氧化物。電解電解CuSO4溶液溶液(3)放氧生酸型:放氧生酸型:電解電解NaCl溶液的分析溶液的分析陰極陰極陽(yáng)極陽(yáng)極氫氫氣氣氯氯氣氣實(shí)例實(shí)例電極反應(yīng)電極反應(yīng) 濃度濃度PH值值復(fù)原
10���、復(fù)原NaCl 陽(yáng)極陽(yáng)極: 2Cl- 2e- = Cl 2陰極陰極: 2H + 2e- = H2 2NaCl+2H2O 2NaOH+H2 + Cl2 電解減小減小增增大大 加加HCl如電解如電解NaCl���、KCl、MgCl2溶液等���。溶液等��。 電解后原溶液中電解后原溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)減小溶質(zhì)的質(zhì)量分?jǐn)?shù)減小��,若����,若要恢復(fù)原來(lái)的組成和濃度��,需通入一定量的要恢復(fù)原來(lái)的組成和濃度��,需通入一定量的HCl氣體����。氣體���。陽(yáng)極陽(yáng)極 (C): 2Cl 2eCl2陰極陰極 (C): 2H+ +2e H2 總反應(yīng)總反應(yīng):2NaCl+2H2O2NaOH+ Cl2 + H2 電解(4)放氫生堿型:放氫生堿型: 11關(guān)于電解關(guān)
11����、于電解NaCl水溶液,下列敘述水溶液���,下列敘述正確的是正確的是A電解時(shí)在陽(yáng)極得到氯氣����,在陰極得到金屬鈉電解時(shí)在陽(yáng)極得到氯氣��,在陰極得到金屬鈉B若在陽(yáng)極附近的溶液中滴入若在陽(yáng)極附近的溶液中滴入KI試液���,溶液呈棕色試液����,溶液呈棕色C若在陰極附近的溶液中滴入酚酞試液��,溶液呈無(wú)色若在陰極附近的溶液中滴入酚酞試液����,溶液呈無(wú)色D電解一段時(shí)間后,將全部電解液轉(zhuǎn)移到燒杯中����,充分電解一段時(shí)間后���,將全部電解液轉(zhuǎn)移到燒杯中,充分?jǐn)嚢韬笕芤撼手行詳嚢韬笕芤撼手行訠16右圖是電解右圖是電解CuCl2溶液的裝置��,溶液的裝置����,其中其中c、d為石墨電極����。則下列有關(guān)的判斷正確的為石墨電極。則下列有關(guān)的判斷正確的是是A.a為負(fù)極��、為負(fù)極����、b為正極為正極 B.a為陽(yáng)極、為陽(yáng)極��、b為陰極為陰極C.電解過(guò)程中��,電解過(guò)程中���,d電極質(zhì)量增加電極質(zhì)量增加 D.電解過(guò)程中����,氯離子濃度不變電解過(guò)程中��,氯離子濃度不變C
 浙江省蒼南縣高中化學(xué) 專題2 化學(xué)反應(yīng)與能量轉(zhuǎn)化 2.3.2 電能轉(zhuǎn)化為化學(xué)能(2)課件 蘇教版必修2
浙江省蒼南縣高中化學(xué) 專題2 化學(xué)反應(yīng)與能量轉(zhuǎn)化 2.3.2 電能轉(zhuǎn)化為化學(xué)能(2)課件 蘇教版必修2