《專練06 壓軸計(jì)算5題 -備戰(zhàn)2021年中考化學(xué)最后沖刺狂練100題(廣東省專用)(解析版)》由會(huì)員分享���,可在線閱讀���,更多相關(guān)《專練06 壓軸計(jì)算5題 -備戰(zhàn)2021年中考化學(xué)最后沖刺狂練100題(廣東省專用)(解析版)(9頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索���。
1���、中考化學(xué)最后沖刺狂練100題
專練06(壓軸計(jì)算5題)
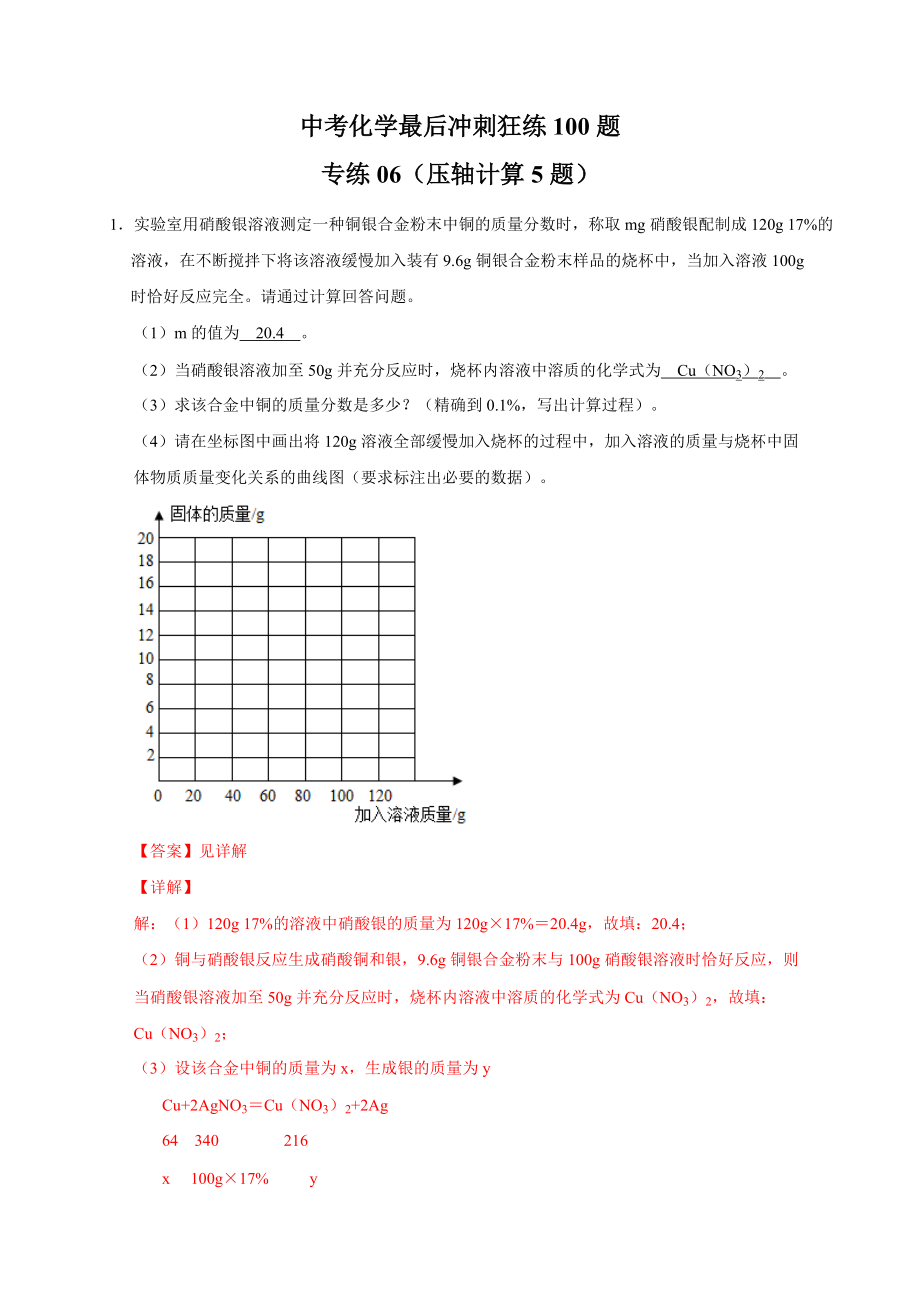
1.實(shí)驗(yàn)室用硝酸銀溶液測(cè)定一種銅銀合金粉末中銅的質(zhì)量分?jǐn)?shù)時(shí)���,稱取mg硝酸銀配制成120g 17%的溶液,在不斷攪拌下將該溶液緩慢加入裝有9.6g銅銀合金粉末樣品的燒杯中���,當(dāng)加入溶液100g時(shí)恰好反應(yīng)完全���。請(qǐng)通過計(jì)算回答問題。
(1)m的值為 20.4 ���。
(2)當(dāng)硝酸銀溶液加至50g并充分反應(yīng)時(shí)���,燒杯內(nèi)溶液中溶質(zhì)的化學(xué)式為 Cu(NO3)2 。
(3)求該合金中銅的質(zhì)量分?jǐn)?shù)是多少���?(精確到0.1%���,寫出計(jì)算過程)���。
(4)請(qǐng)?jiān)谧鴺?biāo)圖中畫出將120g溶液全部緩慢加入燒杯的過程中,加入溶液的質(zhì)量與燒杯中固體物質(zhì)質(zhì)量變化關(guān)系的曲線圖
2���、(要求標(biāo)注出必要的數(shù)據(jù))���。
【答案】見詳解
【詳解】
解:(1)120g 17%的溶液中硝酸銀的質(zhì)量為120g17%=20.4g,故填:20.4���;
(2)銅與硝酸銀反應(yīng)生成硝酸銅和銀���,9.6g銅銀合金粉末與100g硝酸銀溶液時(shí)恰好反應(yīng),則當(dāng)硝酸銀溶液加至50g并充分反應(yīng)時(shí)���,燒杯內(nèi)溶液中溶質(zhì)的化學(xué)式為Cu(NO3)2���,故填:Cu(NO3)2;
(3)設(shè)該合金中銅的質(zhì)量為x���,生成銀的質(zhì)量為y
Cu+2AgNO3=Cu(NO3)2+2Ag
64 340 216
x 100g17%
3���、 y
==
x=3.2g y=10.8g
則該合金中銅的質(zhì)量分?jǐn)?shù)是 100%≈33.3%
答:該合金中銅的質(zhì)量分?jǐn)?shù)是33.3%���;
(4)綜合分析題意可知,燒杯原有樣品的質(zhì)量為9.6g���,隨著硝酸銀溶液質(zhì)量的增加���,固體質(zhì)量增加���,當(dāng)加入100g硝酸銀溶液時(shí)���,固體質(zhì)量為9.6g﹣3.2g+10.8g=17.2g,繼續(xù)加入硝酸銀溶液時(shí)���,固體質(zhì)量不再改變���;則加入溶液的質(zhì)量與燒杯中固體物質(zhì)質(zhì)量變化關(guān)系如圖
,故填:���。
2.中和反應(yīng)是一類重要的化學(xué)反應(yīng)���。某同學(xué)利用圖1裝置研究稀鹽酸與氫氧化鈉溶液反應(yīng)的過程���。取50g稀鹽酸(
4、或氫氧化鈉溶液)���,滴加氫氧化鈉溶液(或稀鹽酸)進(jìn)行實(shí)驗(yàn)���,并用pH和溫度傳感器測(cè)量反應(yīng)過程中相關(guān)物理量的變化情況,得到圖2和圖3���。已知所選稀鹽酸的溶質(zhì)質(zhì)量分?jǐn)?shù)為10%���。
(1)恰好反應(yīng)時(shí)消耗稀鹽酸溶液的質(zhì)量是 73g 。
(2)計(jì)算所用氫氧化鈉溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)���,并寫出計(jì)算過程���。
(3)請(qǐng)?jiān)趫D4中畫出所滴加溶液質(zhì)量與生成氯化鈉的質(zhì)量的關(guān)系圖,在圖中標(biāo)出關(guān)鍵數(shù)據(jù)���。
(4)由圖3可知���,中和反應(yīng)是放熱反應(yīng)���,圖中“f﹣g”溫度下降的原因是 一是溶液自然冷卻,二是加入冷的鹽酸起到冷卻作用 ���。
【答案】見詳解
【詳解】
解:(1)分析圖2可知���,溶液的pH由大于7開始,該實(shí)驗(yàn)是取50g氫
5���、氧化鈉溶液,滴加稀鹽酸���,當(dāng)?shù)稳胂←}酸的質(zhì)量為73g時(shí)���,溶液的pH=7,說(shuō)明73g稀鹽酸與50g氫氧化鈉溶液恰好完全反應(yīng)���,則恰好反應(yīng)時(shí)消耗稀鹽酸的質(zhì)量是73g���,故填:73g���;
(2)設(shè)50g氫氧化鈉溶液中氫氧化鈉的質(zhì)量為x,生成氯化鈉的質(zhì)量為y���,
NaOH+HCl=NaCl+H2O
40 36.5 58.5
x 73g10% y
==
x=8g y=11.7g
則所用氫氧化鈉溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)為100%=16%
答:所用氫
6���、氧化鈉溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)為16%;
(3)所滴加溶液質(zhì)量與生成氯化鈉的質(zhì)量的關(guān)系圖���,故填:���;
(4)分析圖3可知,e﹣f溫度逐漸上升���,其原因是氫氧化鈉與稀鹽酸反應(yīng)發(fā)生中和反應(yīng)放出熱量���,f﹣g溫度逐漸下降,其原因一是溶液自然冷卻���,二是加入冷的鹽酸起到冷卻作用���,故填:一是溶液自然冷卻���,二是加入冷的鹽酸起到冷卻作用。
3.中和反應(yīng)是一類重要的化學(xué)反應(yīng)���,某同學(xué)利用圖1裝置研究稀鹽酸與氫氧化鈉溶液反應(yīng)的過程���,分別取稀鹽酸和氫氧化鈉溶液各50g進(jìn)行實(shí)驗(yàn)���,并用pH和溫度傳感器測(cè)量反應(yīng)過程中相關(guān)物理量的變化情況,得到圖2和圖3���。已知所選稀鹽酸的溶質(zhì)質(zhì)量分?jǐn)?shù)為10%���。
(1)儀器A中溶液的溶質(zhì)是 H
7、Cl?��。ㄌ罨瘜W(xué)式)。
(2)圖3中M的數(shù)值最接近 40 g���。
(3)列方程式計(jì)算所用氫氧化鈉溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)(結(jié)果精確到0.1%)���。
(4)請(qǐng)?jiān)趫D4中畫出滴加溶液過程中所滴加溶液質(zhì)量與生成的氯化鈉的質(zhì)量的關(guān)系圖���,并標(biāo)出拐點(diǎn)坐標(biāo)。
【答案】見詳解
【詳解】
解:(1)分析圖2中pH值的變化可知���,從大于7到小于7���,圖1中是將稀鹽酸滴入到氫氧化鈉溶液中,則A中溶液中的溶質(zhì)為HCl���,故填:HCl���;
(2)氫氧化鈉與稀鹽酸反應(yīng)是中和反應(yīng),中和反應(yīng)是放熱反應(yīng)���,分析圖2可知���,當(dāng)?shù)稳臌}酸的量為40g時(shí)與50g氫氧化鈉溶液恰好完全反應(yīng),則恰好完全反應(yīng)時(shí)放出的熱量最大���,分析圖3可知M點(diǎn)數(shù)值接近40
8���、���,故填:40;
(3)設(shè)氫氧化鈉的質(zhì)量為x���,生成氯化鈉的質(zhì)量為y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
x 40g10% y
==
x≈4.38g y≈6.4g
則氫氧化鈉溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)為100%≈8.8%���,
答:氫氧化鈉溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)為8.8%;
(4)圖4中畫出滴加溶液過程中所滴加溶液質(zhì)量與生成的氯化鈉的質(zhì)量的關(guān)系如圖:���,故填:���。
4.測(cè)定實(shí)驗(yàn)中使用的標(biāo)有質(zhì)量分?jǐn)?shù)為16%的鹽酸(圖
9、1)的實(shí)際質(zhì)量分?jǐn)?shù)���。
(1)為了測(cè)定���,需配制20%的氫氧化鈉溶液100g。需氫氧化鈉 20 g���。
(2)該鹽酸的實(shí)際質(zhì)量分?jǐn)?shù)與標(biāo)簽上標(biāo)出的質(zhì)量分?jǐn)?shù)不一致的可能原因 鹽酸具有揮發(fā)性?��。ú豢紤]誤差)。
(3)小明同學(xué)在燒杯中加入配得的氫氧化鈉溶液20g���,再逐滴加入該鹽酸���。用pH測(cè)定儀測(cè)定滴加過程中溶液的pH.圖2為測(cè)定儀打印出的滴加鹽酸的質(zhì)量與溶液pH的關(guān)系圖。
①a點(diǎn)對(duì)應(yīng)的溶液呈 酸性?��。ㄌ睢八嵝浴?��、“堿性”或“中性”);b點(diǎn)對(duì)應(yīng)的溶液中的溶質(zhì)有 NaCl���、NaOH ���。
②請(qǐng)以此次測(cè)定的數(shù)據(jù),列式計(jì)算該鹽酸的實(shí)際質(zhì)量分?jǐn)?shù)���?
【答案】見詳解
【詳解】
解:(1)配制時(shí)���,需稱取氫
10���、氧化鈉質(zhì)量:100g20%=20g;
(2)鹽酸具有揮發(fā)性���,是導(dǎo)致鹽酸溶液溶質(zhì)質(zhì)量分?jǐn)?shù)減少的原因���;
(3)①由圖示可知,當(dāng)?shù)渭欲}酸到圖象中a點(diǎn)時(shí)���,pH<7���,說(shuō)明鹽酸的量過量,溶液呈現(xiàn)酸性���;當(dāng)?shù)渭欲}酸到圖象中b點(diǎn)時(shí)���,pH>7,說(shuō)明鹽酸的量不足���,溶液呈現(xiàn)堿性���,部分氫氧化鈉參加反應(yīng)生成了氯化鈉���,還有剩余的氫氧化鈉���,所以溶液中的溶質(zhì)是:NaCl���、NaOH;
②設(shè)此鹽酸的質(zhì)量分?jǐn)?shù)為x���。
恰好完全反應(yīng)時(shí)消耗氫氧化鈉質(zhì)量:20g20%=4g���,
NaOH+HCl═H2O+NaCl,
40 36.5
4g 25gx
=���,x=14.6%���,
答:鹽酸的實(shí)際質(zhì)量分?jǐn)?shù)是1
11、4.6%���。
故答案為:
(1)20���;(2)鹽酸具有揮發(fā)性���;(3)①酸性;NaCl���、NaOH���; ②14.6%。
5.現(xiàn)有HCl與CaCl2的混合溶液���,為了分析混合溶液中HCl和CaCl2的質(zhì)量分?jǐn)?shù)���,設(shè)計(jì)了如下實(shí)驗(yàn)方案:
【實(shí)驗(yàn)數(shù)據(jù)】實(shí)驗(yàn)共記錄了兩組數(shù)據(jù):第①組,氣體吸收完全后���,NaOH溶液質(zhì)量增加4.4g���;第②組,沉淀完全后���,經(jīng)過濾���、洗滌���、烘干后得到固體的質(zhì)量為10g。
根據(jù)實(shí)驗(yàn)設(shè)計(jì)及有關(guān)數(shù)據(jù)進(jìn)行分析與計(jì)算:
(1)混合溶液與碳酸鈉溶液反應(yīng)生成的CO2的質(zhì)量為 4.4 g���。
(2)混合溶液中HCl的質(zhì)量分?jǐn)?shù)為多少?
(3)若在100g混合溶液中不斷加入10.6%的Na2CO
12���、3的溶液���,請(qǐng)你畫出加入Na2CO3溶液的質(zhì)量與產(chǎn)生沉淀的質(zhì)量的關(guān)系圖。
【答案】見詳解
【詳解】
解:(1)氫氧化鈉溶液增加的質(zhì)量即為反應(yīng)生成二氧化碳的質(zhì)量���,因此混合溶液與碳酸鈉溶液反應(yīng)生成的CO2的質(zhì)量為4.4g���。
故填:4.4。
(2)解:設(shè)混合溶液中 HCl 的質(zhì)量為 x���,和稀鹽酸反應(yīng)的碳酸鈉溶液質(zhì)量為y���,
Na2CO3+2HCl=2NaCl+CO2↑+H2O���,
106 73 44
y10.6% x 4.4g
==,
x=7.3g���,y=100g���,
混合溶液中 HCl 的質(zhì)量分?jǐn)?shù)為:100%=7.3%,
答:混合溶液中 HCl 的質(zhì)量分?jǐn)?shù)為7.3%���。
(3)設(shè)與氯化鈣反應(yīng)的碳酸鈉溶液質(zhì)量為z���,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 100
z10.6% 10g
=���,
z=100g���,
加入Na2CO3溶液的質(zhì)量與產(chǎn)生沉淀的質(zhì)量的關(guān)系圖如下所示:
。
故答案為:���。
 專練06 壓軸計(jì)算5題 -備戰(zhàn)2021年中考化學(xué)最后沖刺狂練100題(廣東省專用)(解析版)
專練06 壓軸計(jì)算5題 -備戰(zhàn)2021年中考化學(xué)最后沖刺狂練100題(廣東省專用)(解析版)