《2022年高一化學(xué)《第一章 從實(shí)驗(yàn)學(xué)化》學(xué)案》由會(huì)員分享,可在線閱讀�,更多相關(guān)《2022年高一化學(xué)《第一章 從實(shí)驗(yàn)學(xué)化》學(xué)案(3頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
1��、2022年高一化學(xué)《第一章 從實(shí)驗(yàn)學(xué)化》學(xué)案
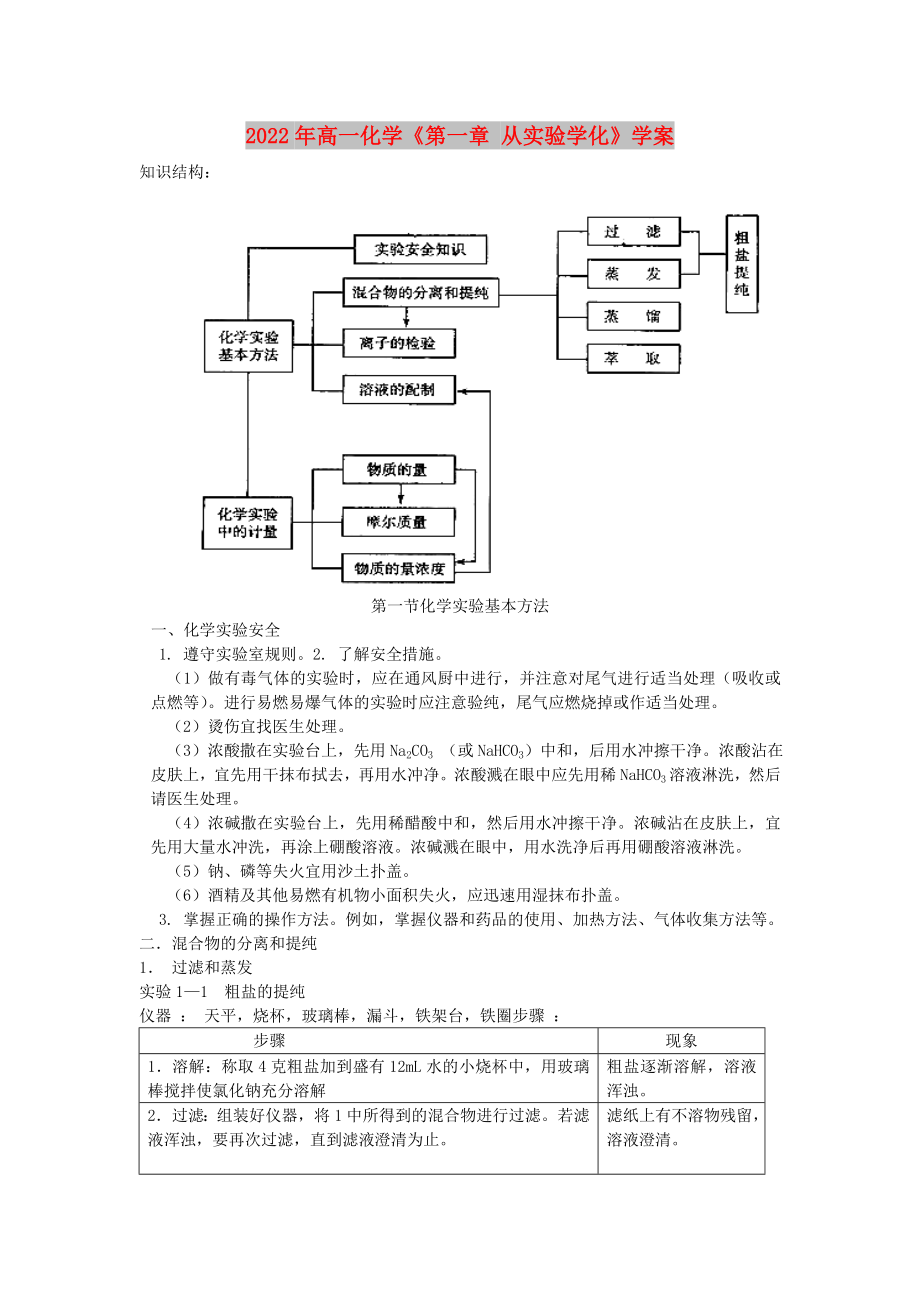
知識(shí)結(jié)構(gòu):
第一節(jié)化學(xué)實(shí)驗(yàn)基本方法
一����、化學(xué)實(shí)驗(yàn)安全
1. 遵守實(shí)驗(yàn)室規(guī)則。2. 了解安全措施�。
(1)做有毒氣體的實(shí)驗(yàn)時(shí),應(yīng)在通風(fēng)廚中進(jìn)行����,并注意對(duì)尾氣進(jìn)行適當(dāng)處理(吸收或點(diǎn)燃等)。進(jìn)行易燃易爆氣體的實(shí)驗(yàn)時(shí)應(yīng)注意驗(yàn)純���,尾氣應(yīng)燃燒掉或作適當(dāng)處理�。
(2)燙傷宜找醫(yī)生處理��。
(3)濃酸撒在實(shí)驗(yàn)臺(tái)上���,先用Na2CO3 (或NaHCO3)中和�,后用水沖擦干凈。濃酸沾在皮膚上�����,宜先用干抹布拭去�,再用水沖凈。濃酸濺在眼中應(yīng)先用稀NaHCO3溶液淋洗����,然后請(qǐng)醫(yī)生處理。
(4)濃堿撒在實(shí)驗(yàn)臺(tái)上�,先用稀醋酸中和,然后用水沖擦干凈��。濃堿沾
2��、在皮膚上��,宜先用大量水沖洗����,再涂上硼酸溶液。濃堿濺在眼中��,用水洗凈后再用硼酸溶液淋洗���。
(5)鈉�����、磷等失火宜用沙土撲蓋����。
(6)酒精及其他易燃有機(jī)物小面積失火���,應(yīng)迅速用濕抹布撲蓋�����。
3. 掌握正確的操作方法����。例如�����,掌握儀器和藥品的使用����、加熱方法����、氣體收集方法等�。
二.混合物的分離和提純
1. 過濾和蒸發(fā)
實(shí)驗(yàn)1—1 粗鹽的提純
儀器 : 天平,燒杯����,玻璃棒,漏斗�,鐵架臺(tái),鐵圈步驟 :
步驟
現(xiàn)象
1.溶解:稱取4克粗鹽加到盛有12mL水的小燒杯中��,用玻璃棒攪拌使氯化鈉充分溶解
粗鹽逐漸溶解���,溶液渾濁�����。
2.過濾:組裝好儀器�,將1中所得到的
3��、混合物進(jìn)行過濾����。若濾液渾濁���,要再次過濾����,直到濾液澄清為止。
濾紙上有不溶物殘留����,溶液澄清。
3.蒸發(fā):將過濾后的澄清溶液轉(zhuǎn)入蒸發(fā)皿����,加熱,并用玻璃棒攪拌����,防止液滴飛濺。當(dāng)出現(xiàn)較多固體時(shí)停止加熱����,余熱蒸干。
蒸發(fā)皿中產(chǎn)生了白色固體�。
注意事項(xiàng):(1)一貼�����,二低����,三靠���。
(2)蒸餾過程中用玻璃棒攪拌�,防止液滴飛濺�。
2. 蒸餾和萃取(1) 蒸餾
原理:利用沸點(diǎn)的不同����,處去難揮發(fā)或不揮發(fā)的雜質(zhì)。
實(shí)驗(yàn)1---3 從自來水制取蒸餾水
儀器:溫度計(jì)��,蒸餾燒瓶�,石棉網(wǎng),鐵架臺(tái)�,酒精燈,冷凝管�����,牛角管,錐形瓶���。
操作:連接好裝置���,通入冷凝水,開始加熱�����。棄去開始鎦出的部分液
4����、體,用錐形瓶收集約10mL液體,停止加熱.
現(xiàn)象: 隨著加熱,燒瓶中水溫升高至100度后沸騰,錐形瓶中收集到蒸餾水.
注意事項(xiàng):①溫度計(jì)的水銀球在蒸餾燒瓶的支管口處�����。
②蒸餾燒瓶中放少量碎瓷片-----防液體暴沸����。
③冷凝管中冷卻水從下口進(jìn),上口出���。
④先打開冷凝水��,再加熱��。
⑤溶液不可蒸干�����。
(2)萃取
原理: 用一種溶把溶質(zhì)從它與另一溶劑所組成的溶液里提取出來.
儀器: 分液漏斗, 燒杯
步驟: ①檢驗(yàn)分液漏斗是否漏水.
②量取10mL碘的飽和溶液倒入分液漏斗, 注入4mLCCl4,蓋好瓶塞.
③用右手壓住分液漏斗口部, 左手握住活塞部分, 把分液漏
5��、斗倒轉(zhuǎn)過來用力振蕩.
④將分液漏斗放在鐵架臺(tái)上,靜置.
⑤待液體分層后, 將分液漏斗上的玻璃塞打開,從下端口放出下層溶液,從上端口倒出上層溶液.
注意事項(xiàng): A 檢驗(yàn)分液漏斗是否漏水.
B 萃取劑: 互不相溶,不能反應(yīng).
C 上層溶液從上口倒出,下層溶液從下口放出.
三. 離子檢驗(yàn)
離子
所加試劑
現(xiàn)象
離子方程式
Cl-
AgNO3,稀HNO3
產(chǎn)生白色沉淀
Cl-+Ag+=AgCl↓
SO42-
Ba(NO3)2稀HNO3
白色沉淀
SO42-+Ba2+=BaSO4↓
四.除雜
1.原則:雜轉(zhuǎn)純�、雜變沉、化為氣�、溶劑分。
2.注意
6���、:為了使雜質(zhì)除盡�,加入的試劑不能是“適量”�����,而應(yīng)是“過量”����;但過量的試劑必須在后續(xù)操作中便于除去。
第二節(jié) 化學(xué)計(jì)量在實(shí)驗(yàn)中的應(yīng)用
一、物質(zhì)的量的單位――摩爾
1.物質(zhì)的量(n)是表示含有一定數(shù)目粒子的集體的物理量�����。七個(gè)基本物理量之一��。
2.摩爾(mol): 把含有6.02 ×1023個(gè)粒子的任何粒子集體計(jì)量為1摩爾����。
3.阿伏加德羅常數(shù):1mol物質(zhì)中所含的“微粒數(shù)”。
把6.02 X1023mol-1叫作阿伏加德羅常數(shù)�����。
4.物質(zhì)的量 = 物質(zhì)所含微粒數(shù)目/阿伏加德羅常數(shù) n =N/NA
5.摩爾質(zhì)量(M)
(1) 定義:?jiǎn)挝晃镔|(zhì)的量的物質(zhì)
7�、所具有的質(zhì)量叫摩爾質(zhì)量.(2)單位:g/mol 或 g.mol-1
(3) 數(shù)值:等于該粒子的相對(duì)原子質(zhì)量或相對(duì)分子質(zhì)量.
6.物質(zhì)的量=物質(zhì)的質(zhì)量/摩爾質(zhì)量 ( n = m/M )
二���、氣體摩爾體積
1.氣體摩爾體積(Vm)
(1)定義:?jiǎn)挝晃镔|(zhì)的量的氣體所占的體積叫做氣體摩爾體積.
(2)單位:L/mol 或 m3/mol
2.物質(zhì)的量=氣體的體積/氣體摩爾體積n=V/Vm
3.(1)0℃ 101KPa , Vm = 22.4 L/mol
(2)25℃ 101KPa , Vm = 24.8 L/mol
三����、物質(zhì)的量在化學(xué)實(shí)驗(yàn)中的應(yīng)用
1.物質(zhì)的
8�����、量濃度.
(1)定義:以單位體積溶液里所含溶質(zhì)B的物質(zhì)的量來表示溶液組成的物理量,叫做溶質(zhì)B的物質(zhì)的濃度�����。
(2)單位:mol/L , mol/m3
(3)物質(zhì)的量濃度 = 溶質(zhì)的物質(zhì)的量/溶液的體積 CB = nB/V
2.一定物質(zhì)的量濃度的配制
(1)基本原理:根據(jù)欲配制溶液的體積和溶質(zhì)的物質(zhì)的量濃度���,用有關(guān)物質(zhì)的量濃度計(jì)算的方法����,求出所需溶質(zhì)的質(zhì)量或體積����,在容器內(nèi)將溶質(zhì)用溶劑稀釋為規(guī)定的體積,就得欲配制得溶液.
(2)主要操作
a.檢驗(yàn)是否漏水.
b.配制溶液 1.計(jì)算 2.稱量3.溶解 4.冷卻5.轉(zhuǎn)移 6.洗滌 7.定容 8.搖勻 9.貯存溶液.
注意事項(xiàng):A 選用與欲配制溶液體積相同的容量瓶. B 使用前必須檢查是否漏水. C 不能在容量瓶?jī)?nèi)直接溶解. D 溶解完的溶液等冷卻至室溫時(shí)再轉(zhuǎn)移. E 定容時(shí),當(dāng)液面離刻度線1―2cm時(shí)改用滴管����,以平視法觀察加水至液面最低處與刻度相切為止.
3.溶液稀釋
C(濃溶液)·V(濃溶液) =C(稀溶液)·V(稀溶液)
 2022年高一化學(xué)《第一章 從實(shí)驗(yàn)學(xué)化》學(xué)案
2022年高一化學(xué)《第一章 從實(shí)驗(yàn)學(xué)化》學(xué)案