《精修版魯科版化學(xué)必修1 第三章 自然界中的元素 章末知識(shí)整合》由會(huì)員分享�,可在線閱讀��,更多相關(guān)《精修版魯科版化學(xué)必修1 第三章 自然界中的元素 章末知識(shí)整合(3頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索����。
1、 精品資料
章末知識(shí)整合
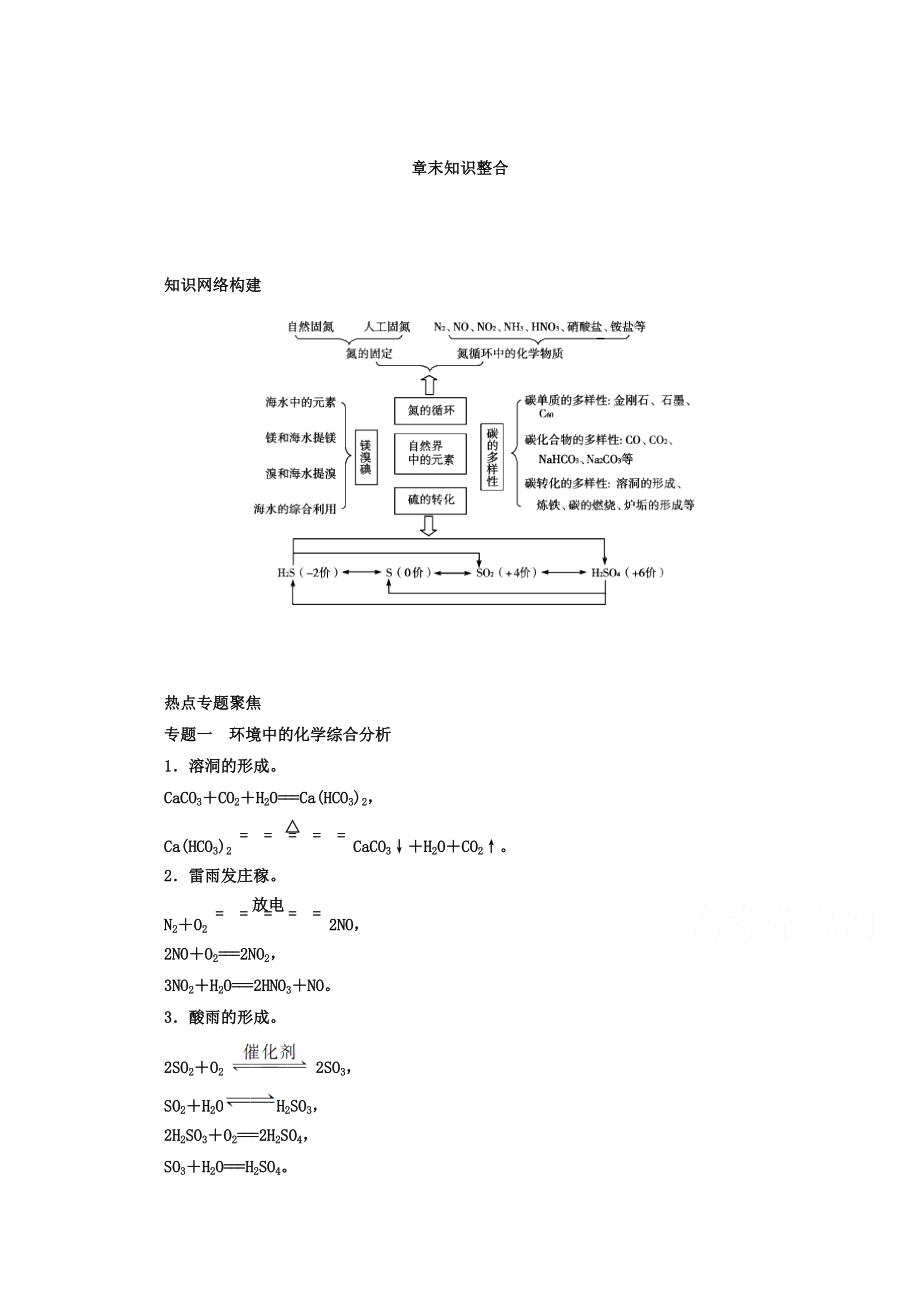
知識(shí)網(wǎng)絡(luò)構(gòu)建
熱點(diǎn)專(zhuān)題聚焦
專(zhuān)題一 環(huán)境中的化學(xué)綜合分析
1.溶洞的形成�。
CaCO3+CO2+H2O===Ca(HCO3)2,
Ca(HCO3)2CaCO3↓+H2O+CO2↑���。
2.雷雨發(fā)莊稼��。
N2+O22NO���,
2NO+O2===2NO2���,
3NO2+H2O===2HNO3+NO。
3.酸雨的形成�����。
2SO2+O2 2SO3��,
SO2+H2OH2SO3�����,
2H2SO3+O2===2H2SO4���,
SO3+H2O===H2SO4����。
4.光化學(xué)煙霧���。
2����、汽車(chē)尾氣中的氮氧化物與碳?xì)浠锝?jīng)紫外線照射發(fā)生反應(yīng)形成的一種有毒的煙霧,稱(chēng)為光化學(xué)煙霧���。
5.水體富營(yíng)養(yǎng)化����。
進(jìn)入水體的氮的含量增大�,導(dǎo)致藻類(lèi)“瘋長(zhǎng)”�����,迅速覆蓋在水面上�����,造成水體缺氧�����,使水中的生物大量死亡���。
專(zhuān)題二 有關(guān)“噴泉實(shí)驗(yàn)”思想的綜合應(yīng)用
1.噴泉是一種液體噴涌現(xiàn)象���,其成因有四個(gè)要素:(1)有待噴的液體�;(2)有噴起的液體接納空間��;(3)待噴的液體與噴起的液體之間有順暢的通道����;(4)待噴的液體與噴起的液體的接納空間之間有足夠大的壓力差(前者的壓力大于后者的壓力)。
2.噴泉現(xiàn)象既有天然的���,又有人為的���。就實(shí)驗(yàn)室里的噴泉現(xiàn)象而言,噴起液體的接納空間壓強(qiáng)變小的原因有:(1)氣體物質(zhì)
3�、的量一定,溫度降低��;(2)氣體的溫度一定�����,物質(zhì)的量因氣體溶解而減?�。?3)氣體溫度降低的同時(shí)又有氣體物質(zhì)的量減少�����。
3.噴泉實(shí)驗(yàn)成功的關(guān)鍵是:(1)盛氣體的燒瓶必須干燥�,否則瓶中有液體,會(huì)使瓶口留下空氣�����,形成的噴泉壓力不大(噴泉“無(wú)力”)���;(2)氣體要充滿燒瓶�;(3)燒瓶不能漏氣(實(shí)驗(yàn)前應(yīng)先檢查裝置的氣密性)���;(4)所用氣體能大量溶于所用液體或氣體與液體快速反應(yīng)。
4.噴泉實(shí)驗(yàn)的本質(zhì)是形成壓強(qiáng)差而引發(fā)液體上噴���,為此可設(shè)計(jì)多種不同的裝置和采用不同的操作(如使氣體溶于水�����、熱敷�����、生成氣體��、發(fā)生氣體體積減小的反應(yīng)等)來(lái)使噴泉產(chǎn)生�����。
裝置Ⅱ:擠壓氣球�����,即可使少量的溶液沿導(dǎo)管進(jìn)入燒瓶中���,導(dǎo)致
4���、大量的NH3 溶解,燒瓶?jī)?nèi)形成負(fù)壓而產(chǎn)生噴泉����。
裝置Ⅲ:去掉了膠頭滴管。打開(kāi)止水夾���,用手(或熱毛巾等)捂熱燒瓶�����,氨氣受熱膨脹���,使氨氣通過(guò)導(dǎo)管與水接觸���,即產(chǎn)生噴泉(開(kāi)放性問(wèn)題,或用浸冰水的毛巾“冷敷”燒瓶����,使水進(jìn)入燒瓶,燒瓶?jī)?nèi)氨氣溶于水)�。
裝置Ⅳ:在錐形瓶中加入能產(chǎn)生氣體的物質(zhì),使錐形瓶?jī)?nèi)氣體的壓強(qiáng)明顯增大�,將液體壓入燒瓶而產(chǎn)生噴泉。
裝置Ⅴ:在水槽中加入使水溫度升高的物質(zhì)���,致使錐形瓶?jī)?nèi)酒精因升溫而揮發(fā),錐形瓶?jī)?nèi)氣體壓強(qiáng)增大而產(chǎn)生噴泉���。
裝置Ⅵ:燒瓶中通入H2S(或SO2)��,然后通入SO2 (或H2S)�����,現(xiàn)象為有淡黃色粉末狀物質(zhì)生成�����,瓶?jī)?nèi)壁附有水珠��,NaOH溶液噴到燒瓶?jī)?nèi)����。
裝置Ⅶ:
5、打開(kāi)①處的止水夾并向燒瓶中通入少量HCl氣體后關(guān)閉止水夾��,再打開(kāi)②處的止水夾�����。觀察到先產(chǎn)生白煙�����,生成固體NH4Cl�,瓶?jī)?nèi)氣壓降低,形成噴泉。
裝置Ⅷ:先擠壓膠頭滴管���,再打開(kāi)a��、c活塞��,然后打開(kāi)b活塞����,可產(chǎn)生雙噴泉現(xiàn)象�����。
專(zhuān)題三 多步反應(yīng)計(jì)算
1.若化學(xué)計(jì)算涉及幾個(gè)化學(xué)方程式��,且一個(gè)方程式的生成物又是另一個(gè)方程式中的反應(yīng)物時(shí)����,我們稱(chēng)這種計(jì)算為多步反應(yīng)計(jì)算,多步反應(yīng)的基本解法是關(guān)系式法���。它不需要按每個(gè)化學(xué)方程式逐一計(jì)算���,而應(yīng)找出相應(yīng)的關(guān)系式一步運(yùn)算。要找出正確的關(guān)系式首先應(yīng)正確地寫(xiě)出各步化學(xué)反應(yīng)方程式���,按照方程式中物質(zhì)的化學(xué)計(jì)量數(shù)關(guān)系找出已知量和未知量相應(yīng)的關(guān)系式���,并進(jìn)行計(jì)算。例如用接觸法制硫酸�,各步化學(xué)方程式如下: 4FeS2+11O22Fe2O3+8SO2;2SO2+O22SO3���;SO3+H2O===H2SO4��。由三個(gè)方程式可得關(guān)系式FeS2~2H2SO4�����;若以S原子來(lái)分析�����,又可得關(guān)系式S~H2SO4�。
2.在遇到原料或中間物質(zhì)不能全部進(jìn)入產(chǎn)物的情況下�,應(yīng)進(jìn)行如下處理:
化合物中某元素的損失率=該化合物損失率;中間產(chǎn)物的損失率=原料的損失率�;中間產(chǎn)物的轉(zhuǎn)化率=原料的轉(zhuǎn)化率。
 精修版魯科版化學(xué)必修1 第三章 自然界中的元素 章末知識(shí)整合
精修版魯科版化學(xué)必修1 第三章 自然界中的元素 章末知識(shí)整合