《2014屆高三化學(xué)一輪 練出高分 10.2物質(zhì)制備與工藝流程分析型實(shí)驗(yàn)題 新人教版》由會(huì)員分享�����,可在線閱讀,更多相關(guān)《2014屆高三化學(xué)一輪 練出高分 10.2物質(zhì)制備與工藝流程分析型實(shí)驗(yàn)題 新人教版(5頁珍藏版)》請?jiān)谘b配圖網(wǎng)上搜索��。
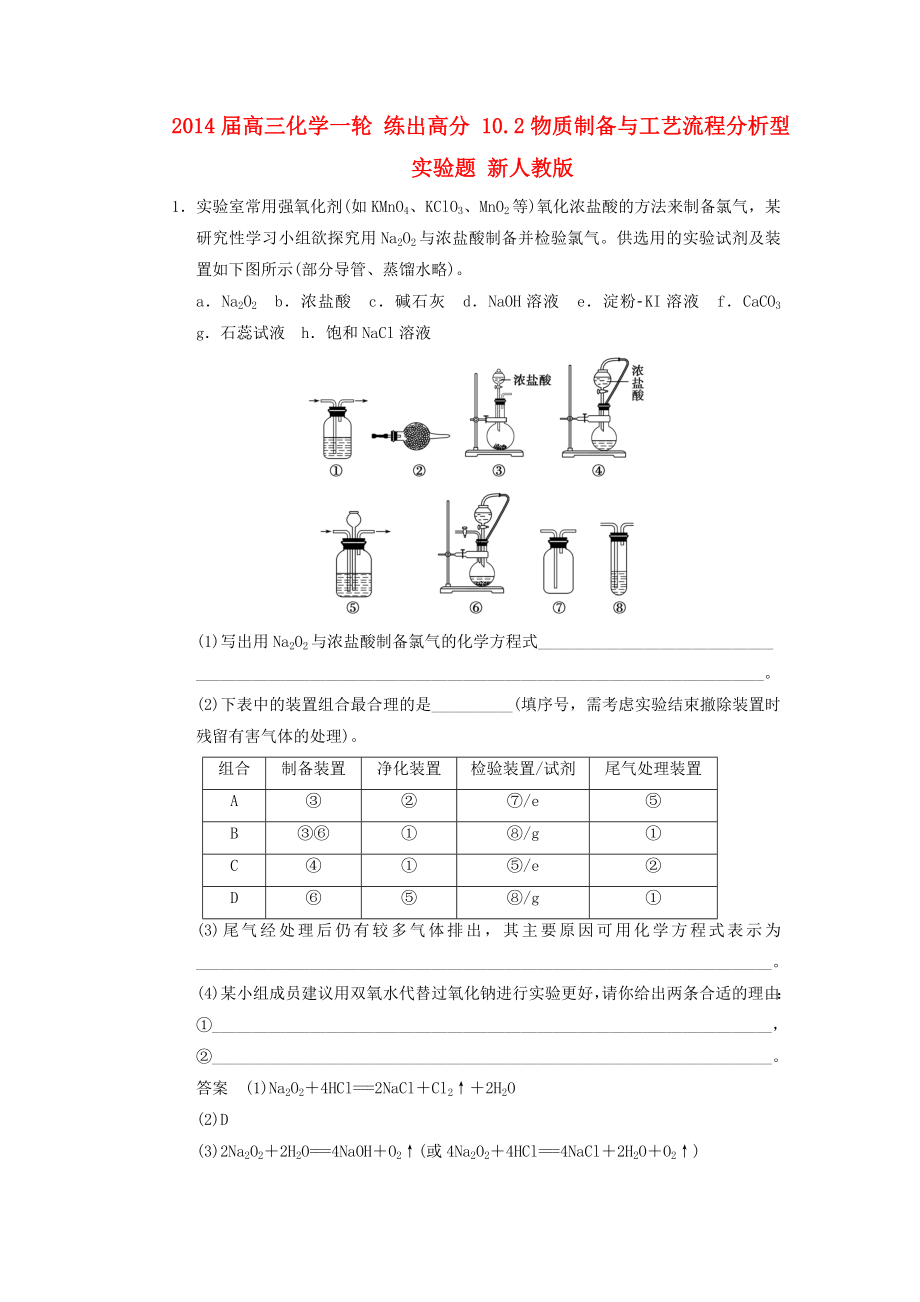
1����、2014屆高三化學(xué)一輪 練出高分 10.2物質(zhì)制備與工藝流程分析型實(shí)驗(yàn)題 新人教版1實(shí)驗(yàn)室常用強(qiáng)氧化劑(如KMnO4、KClO3����、MnO2等)氧化濃鹽酸的方法來制備氯氣,某研究性學(xué)習(xí)小組欲探究用Na2O2與濃鹽酸制備并檢驗(yàn)氯氣�。供選用的實(shí)驗(yàn)試劑及裝置如下圖所示(部分導(dǎo)管、蒸餾水略)��。aNa2O2b濃鹽酸c堿石灰dNaOH溶液e淀粉KI溶液fCaCO3g石蕊試液h飽和NaCl溶液(1)寫出用Na2O2與濃鹽酸制備氯氣的化學(xué)方程式_����。(2)下表中的裝置組合最合理的是_(填序號(hào),需考慮實(shí)驗(yàn)結(jié)束撤除裝置時(shí)殘留有害氣體的處理)��。組合制備裝置凈化裝置檢驗(yàn)裝置/試劑尾氣處理裝置A/eB/gC/eD/g(3)
2��、尾氣經(jīng)處理后仍有較多氣體排出�����,其主要原因可用化學(xué)方程式表示為_。(4)某小組成員建議用雙氧水代替過氧化鈉進(jìn)行實(shí)驗(yàn)更好�����,請你給出兩條合適的理由:_���,_。答案(1)Na2O24HCl=2NaClCl22H2O(2)D(3)2Na2O22H2O=4NaOHO2(或4Na2O24HCl=4NaCl2H2OO2)(4)Na2O2能與水反應(yīng)����,會(huì)使原料的利用率降低雙氧水比Na2O2更經(jīng)濟(jì)產(chǎn)生等量的Cl2,用雙氧水消耗鹽酸的量少Na2O2能與水反應(yīng)���,生成的NaOH能與鹽酸反應(yīng)Na2O2能與水反應(yīng)�����,生成的NaOH吸收了Cl2(填寫其中任意兩條即可)解析Na2O2具有強(qiáng)氧化性�,能把Cl氧化成Cl2�����,制備時(shí)應(yīng)把濃鹽
3����、酸滴到Na2O2固體上�,所以應(yīng)選作為制備裝置�,裝置可觀察導(dǎo)氣管是否堵塞,利用KI淀粉溶液或石蕊試液檢驗(yàn)Cl2����,根據(jù)裝置應(yīng)選擇/g,可用NaOH溶液吸收Cl2�。在此實(shí)驗(yàn)中,不可避免Na2O2和水反應(yīng)生成Cl2�����。2次硫酸氫鈉甲醛(NaHSO2HCHO2H2O)在印染����、醫(yī)藥以及原子能工業(yè)中應(yīng)用廣泛,已知次硫酸氫鈉甲醛具有強(qiáng)還原性�,且在120 以上發(fā)生分解。以Na2SO3����、SO2、HCHO和鋅粉為原料制備次硫酸氫鈉甲醛的實(shí)驗(yàn)步驟如下:步驟1:在燒瓶中(裝置如圖所示)加入一定量Na2SO3和水,攪拌溶解�����,緩慢通入SO2���,至溶液pH約為4���,制得NaHSO3溶液�。步驟2:將裝置A中導(dǎo)氣管換成橡皮塞。向燒瓶中
4�����、加入稍過量的鋅粉和一定量甲醛溶液�����,在8090 下��,反應(yīng)約3 h��,冷卻至室溫�,抽濾。步驟3:將濾液真空蒸發(fā)濃縮,冷卻結(jié)晶�,抽濾。(1)儀器A的名稱為_�,冷凝管進(jìn)水口_(填“a”或“b”),裝置C的作用是_���。(2)步驟2中���,應(yīng)采用何種加熱方式_,優(yōu)點(diǎn)是_���;冷凝管中回流的主要物質(zhì)除H2O外還有_(填化學(xué)式)����。(3)在抽濾操作中�,儀器除抽氣泵、燒杯���、玻璃棒�、布氏漏斗外��,還必須使用屬于硅酸鹽材料的儀器(或裝置)有_��。抽濾所用的濾紙應(yīng)略_(填“大于”或“小于”)布氏漏斗內(nèi)徑,并將全部小孔蓋住�。(4)步驟3中不在敞口容器中蒸發(fā)濃縮的原因是_。答案(1)三頸燒瓶a吸收二氧化硫��,并防止倒吸(2)水浴加熱均勻受熱
5����、、容易控制溫度HCHO(3)抽濾瓶��、安全瓶小于(4)防止產(chǎn)物被空氣氧化解析(1)由于冷凝管的作用是冷凝回流����,所以冷凝水應(yīng)從下口通入�。(2)根據(jù)次硫酸氫鈉甲醛的分解溫度應(yīng)選擇水浴加熱,水浴加熱均勻���,且容易控制�����;由于HCHO易揮發(fā)��,應(yīng)使HCHO回流再利用���。(4)由于次硫酸氫鈉甲醛具有強(qiáng)還原性�����,所以蒸發(fā)濃縮時(shí)不能在敞口容器中進(jìn)行����。3綠礬(FeSO47H2O)是治療缺鐵性貧血藥品的重要成分��。下面是以市售鐵屑(含少量錫��、氧化鐵等雜質(zhì))為原料生產(chǎn)純凈綠礬的一種方法:查詢資料���,得有關(guān)物質(zhì)的數(shù)據(jù)如下表:25 時(shí)pH值飽和H2S溶液3.9SnS沉淀完全1.6FeS開始沉淀3.0FeS沉淀完全5.5(1)檢驗(yàn)制得
6�、的綠礬晶體中是否含有Fe3�,可選用的試劑為_。AKSCN溶液 BNaOH溶液CKMnO4溶液 D苯酚溶液(2)操作中���,通入硫化氫至飽和的目的是_�����;在溶液中用硫酸酸化至pH2的目的是_��。(3)操作的順序依次為_�、冷卻結(jié)晶、_��。(4)操作得到的綠礬晶體用少量冰水洗滌�����,其目的是:除去晶體表面附著的硫酸等雜質(zhì)����;_。答案(1)AD(2)除去溶液中的Sn2�,并防止Fe2被氧化防止Fe2生成沉淀(3)蒸發(fā)濃縮過濾洗滌(4)降低洗滌過程中FeSO47H2O的損耗解析(1)檢驗(yàn)Fe3可用KSCN或苯酚溶液。(2)操作中���,通入H2S至飽和時(shí),SnS完全沉淀且能防止Fe2被氧化(因?yàn)?價(jià)硫的還原性更強(qiáng))��,加入H2S
7�����、O4��,至pH2,可以防止Fe2生成沉淀����。由于綠礬中帶有結(jié)晶水,所以應(yīng)采取蒸發(fā)濃縮���,冷卻結(jié)晶的方法���,在洗滌沉淀時(shí),用冰水洗滌可降低FeSO47H2O的溶解度����。4化學(xué)實(shí)驗(yàn)室通常用粗鋅和稀硫酸反應(yīng)制氫氣,因此在制氫廢液中含有大量的硫酸鋅���。同時(shí)���,由于粗鋅中還含有鐵等雜質(zhì),使得溶液中混有一定量的硫酸亞鐵�����,為了充分利用制氫廢液����,常用其制備皓礬(ZnSO47H2O)��。某?;瘜W(xué)興趣小組的同學(xué)以制氫氣的廢液為原料來制取皓礬�����。制備皓礬的實(shí)驗(yàn)流程如下圖所示���。已知:開始生成氫氧化物沉淀到沉淀完全的pH范圍分別為Fe(OH)3:2.73.7���;Fe(OH)2:7.69.6;Zn(OH)2:5.78.0�,試回答下列問題:(
8、1)加入的試劑����,供選擇使用的有:氨水、NaClO溶液����、20%的H2O2�����、濃硫酸、濃硝酸等�����,最好選用_�,其理由是_。(2)加入的試劑:供選擇使用的有:a.Zn粉���、b.ZnO�����、c.Zn(OH)2�、d.ZnCO3�、e.ZnSO4等,可選用_����。(3)從晶體1晶體2,該過程的名稱是_�����。(4)在得到皓礬時(shí),向晶體中加入少量酒精洗滌而不用水的原因是_���。答案(1)20%的H2O2將制氫廢液中的Fe2氧化成Fe3���,同時(shí)避免引入新的雜質(zhì)(2)bcd(3)重結(jié)晶(4)為了沖洗掉晶體表面的雜質(zhì)離子;防止晶體溶解����,影響產(chǎn)率解析(1)根據(jù)Fe3、Fe2�、Zn2沉淀的pH值,為了沉淀Fe3���、Fe2而不沉淀Zn2�����,應(yīng)用H2O
9�、2����,把Fe2氧化成Fe3。(2)為了促進(jìn)Fe3水解應(yīng)降低H的濃度,但不能引入雜質(zhì)離子���,所以應(yīng)加入ZnO或Zn(OH)2或ZnCO3,但不能使用Zn粉��,因?yàn)槭菑闹艸2的廢液中制得皓礬���。(3)由于晶體I不純����,所以應(yīng)采取重結(jié)晶的方法����。(4)在洗滌皓礬時(shí),為了減少損失�,可用酒精洗滌。5加碘食鹽中加入的碘酸鉀是一種白色結(jié)晶粉末���,常溫下性質(zhì)穩(wěn)定�,加熱至560 開始分解����。在酸性條件下碘酸鉀是一種較強(qiáng)的氧化劑,可與碘化物、亞硫酸鹽等還原性物質(zhì)反應(yīng)�。工業(yè)生產(chǎn)碘酸鉀的流程如下:(1)已知步驟反應(yīng)器發(fā)生的反應(yīng)中,單質(zhì)碘和氯酸鉀的物質(zhì)的量之比為611�����,則反應(yīng)器中發(fā)生反應(yīng)的化學(xué)方程式為_���。(2)步驟中調(diào)節(jié)pH10的目的
10����、是_��。參照碘酸鉀的溶解度:溫度/20406080KIO3 g/100 g H2O8.0812.618.324.8操作的方法是_�����。(3)檢驗(yàn)加碘食鹽中的碘元素���,學(xué)生甲利用碘酸鉀與碘化鉀在酸性條件下發(fā)生反應(yīng)�,然后用四氯化碳檢驗(yàn)生成的碘單質(zhì)時(shí)�,甲應(yīng)觀察到的明顯現(xiàn)象有_。學(xué)生乙對純凈的NaCl進(jìn)行了如下實(shí)驗(yàn):取1 g純凈的NaCl�����,加3 mL水配成溶液,然后滴入5滴淀粉溶液和1 mL 0.1 molL1 KI溶液��,振蕩����,溶液無變化�����,然后再滴入1滴1 molL1的H2SO4�����,振蕩�,一段時(shí)間后溶液變淺藍(lán)色。請推測實(shí)驗(yàn)中產(chǎn)生藍(lán)色現(xiàn)象的可能原因���,用離子方程式表示_�����。(4)學(xué)生丙查閱有關(guān)食品碘強(qiáng)化劑的資料后知道
11�、,碘酸鈣也是一種允許使用的食品碘強(qiáng)化劑��,它是一種白色結(jié)晶或結(jié)晶性粉末��,難溶于水和乙醇��。丙同學(xué)在氯化鈣溶液中加入理論量的碘酸鉀溶液����,反應(yīng)生成的沉淀經(jīng)水洗后,室溫下干燥得碘酸鈣晶體�,加熱至160540 變成無水物,此時(shí)固體質(zhì)量為原晶體質(zhì)量的78.3%���,寫出制備碘酸鈣晶體的離子方程式:_��;檢驗(yàn)沉淀已經(jīng)洗滌干凈的方法是_�����。答案(1)6I211KClO33H2O=6KH(IO3)25KCl3Cl2(2)使KH(IO3)2轉(zhuǎn)化為KIO3蒸發(fā)結(jié)晶(3)液體分層���,下層液體呈現(xiàn)紫紅色4I4HO2=2I22H2O(4)Ca22IO6H2O=Ca(IO3)26H2O在最后一次洗滌液中加入硝酸銀溶液,若無白色沉淀說明已經(jīng)洗滌干凈解析(2)KH(IO3)2可以和堿反應(yīng)�,所以當(dāng)pH10時(shí)���,可以使KH(IO3)2轉(zhuǎn)化為KIO3,由于KIO3的溶解度受溫度的影響較大且分解溫度較高���,所以采取蒸發(fā)結(jié)晶的方法��。(3)KIO3和KI在酸性條件下發(fā)生氧化還原反應(yīng)生成I2��,加入CCl4,下層呈紫紅色�����。在酸性條件下����,I可被空氣中的O2氧化成I2,所以當(dāng)加入淀粉溶液時(shí)呈藍(lán)色��。(4)設(shè)Ca(IO3)2xH2O����,根據(jù)題意:100%78.3%,x6����,所以Ca22IO6H2O=Ca(IO3)26H2O檢驗(yàn)沉淀是否洗凈����,應(yīng)取最后一次洗滌液�����。
 2014屆高三化學(xué)一輪 練出高分 10.2物質(zhì)制備與工藝流程分析型實(shí)驗(yàn)題 新人教版
2014屆高三化學(xué)一輪 練出高分 10.2物質(zhì)制備與工藝流程分析型實(shí)驗(yàn)題 新人教版