《2022年高中化學(xué) 《豐富多彩的化學(xué)物質(zhì)》教案1 蘇教版必修1》由會(huì)員分享�����,可在線閱讀�,更多相關(guān)《2022年高中化學(xué) 《豐富多彩的化學(xué)物質(zhì)》教案1 蘇教版必修1(4頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
1�����、2022年高中化學(xué) 《豐富多彩的化學(xué)物質(zhì)》教案1 蘇教版必修1
一��、內(nèi)容分析
教材從宏觀和微觀結(jié)合的角度通過(guò)兩個(gè)方面描述了物質(zhì)的多樣性。一是物質(zhì)因聚集狀態(tài)不同���,可以分成氣態(tài)����、液態(tài)和固態(tài)��,并明確指出:三種狀態(tài)下由于微觀結(jié)構(gòu)�、微粒的運(yùn)動(dòng)方式不同,物質(zhì)所表現(xiàn)的宏觀性質(zhì)也不同��。二是物質(zhì)因分散狀態(tài)不同�����,可以分成溶液��、濁液�����、膠體����,其中分散質(zhì)的粒子大小有所不同���。即便是同一種分散系——溶液�����,如食鹽溶液和蔗糖溶液��,它們?cè)谒械拇嬖谛问接指鞑幌嗤?�,這與溶質(zhì)在水中是否電離有關(guān)���。這就初步揭示了物質(zhì)的微觀結(jié)構(gòu)是造成物質(zhì)世界豐富多彩的重要原因�����。
在介紹了物質(zhì)轉(zhuǎn)化的定性關(guān)系后��,教材明確提出新的問(wèn)題:物質(zhì)的研究
2���、應(yīng)關(guān)注轉(zhuǎn)化過(guò)程中的定量關(guān)系。結(jié)合對(duì)化學(xué)反應(yīng)中實(shí)際參加反應(yīng)粒子的質(zhì)量和數(shù)量的分析�����,讓學(xué)生了解“將一定數(shù)目的微觀粒子與可稱量物質(zhì)聯(lián)系起來(lái)”的物理量——物質(zhì)的量,并結(jié)合簡(jiǎn)單的化學(xué)反應(yīng)討論了物質(zhì)的量之間的關(guān)系���,通過(guò)標(biāo)準(zhǔn)狀況下對(duì)氣體行為的描述介紹了氣體摩爾體積和計(jì)量關(guān)系的具體應(yīng)用���。
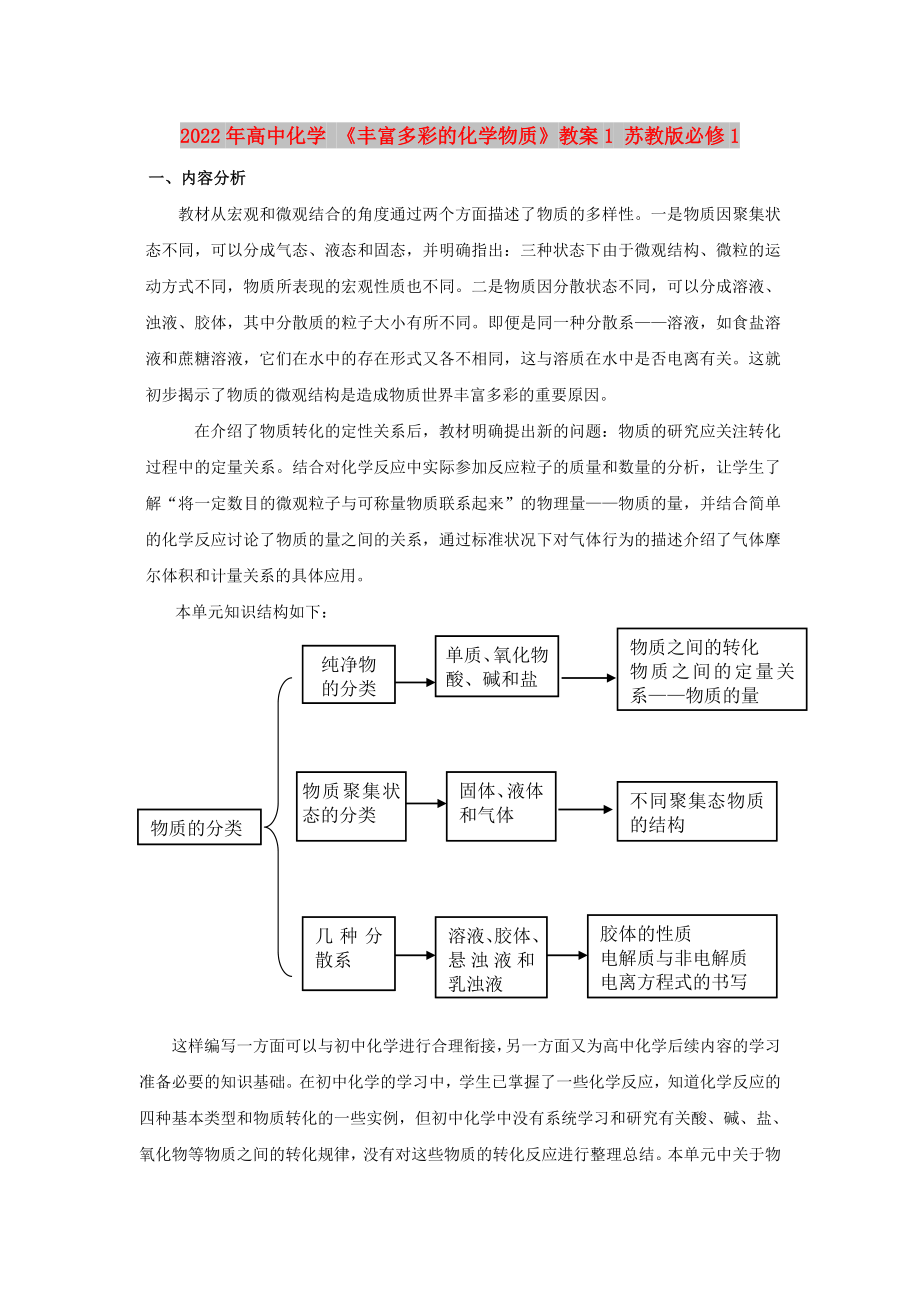
物質(zhì)之間的轉(zhuǎn)化
物質(zhì)之間的定量關(guān)系——物質(zhì)的量
本單元知識(shí)結(jié)構(gòu)如下:
單質(zhì)、氧化物酸�����、堿和鹽
純凈物的分類
固體�����、液體和氣體
物質(zhì)聚集狀態(tài)的分類
不同聚集態(tài)物質(zhì)的結(jié)構(gòu)
氣體摩爾體積概念計(jì)算
物質(zhì)的分類
膠體的性質(zhì)
電解質(zhì)與非電解質(zhì)
電離方程式的書寫
溶液��、膠體���、懸濁液和
3���、乳濁液
幾種分散系
這樣編寫一方面可以與初中化學(xué)進(jìn)行合理銜接,另一方面又為高中化學(xué)后續(xù)內(nèi)容的學(xué)習(xí)準(zhǔn)備必要的知識(shí)基礎(chǔ)�����。在初中化學(xué)的學(xué)習(xí)中,學(xué)生已掌握了一些化學(xué)反應(yīng)����,知道化學(xué)反應(yīng)的四種基本類型和物質(zhì)轉(zhuǎn)化的一些實(shí)例,但初中化學(xué)中沒(méi)有系統(tǒng)學(xué)習(xí)和研究有關(guān)酸����、堿��、鹽�����、氧化物等物質(zhì)之間的轉(zhuǎn)化規(guī)律��,沒(méi)有對(duì)這些物質(zhì)的轉(zhuǎn)化反應(yīng)進(jìn)行整理總結(jié)����。本單元中關(guān)于物質(zhì)的分類和轉(zhuǎn)化內(nèi)容正好可對(duì)初中化學(xué)中學(xué)習(xí)過(guò)的化學(xué)反應(yīng)進(jìn)行總結(jié)和歸納,并進(jìn)行適當(dāng)?shù)耐卣购吞岣?����,幫助學(xué)生更好地認(rèn)識(shí)化學(xué)物質(zhì)���;同時(shí)�,還可以為后面學(xué)習(xí)鈉、鎂����、氯、氮和硫等元素化合物的性質(zhì)和轉(zhuǎn)化規(guī)律打下必要基礎(chǔ)����。在初中化學(xué)的學(xué)習(xí)中,學(xué)生已經(jīng)接觸過(guò)氣體物質(zhì)
4����、、固體沉淀��、溶液����、濁液等具體實(shí)例,本單元中有關(guān)“物質(zhì)的聚集狀態(tài)”�����、“物質(zhì)的分散體系”的內(nèi)容就是在這個(gè)基礎(chǔ)上引導(dǎo)學(xué)生從微觀角度理解化學(xué)物質(zhì)的存在狀態(tài)����,在原有基礎(chǔ)上提升對(duì)化學(xué)物質(zhì)的認(rèn)識(shí)��,同時(shí)為后續(xù)內(nèi)容的學(xué)習(xí)準(zhǔn)備重要的基礎(chǔ)����。
教材在講完溶液���、膠體后���,緊接著安排電解質(zhì)與非電解質(zhì)的知識(shí)點(diǎn)�,這是不同于以往教學(xué)內(nèi)容的。如何理解這種編排呢��?首先從教學(xué)主題——物質(zhì)世界來(lái)說(shuō)����,膠體與溶液的性質(zhì)不同,電解質(zhì)溶液與非電解質(zhì)溶液的性質(zhì)也不同�,而兩種不同都是由分散質(zhì)存在形式的差異引起的;又正是這樣的差異���,造成物質(zhì)世界的豐富多彩性��,教師可以自然而巧妙的將兩部分知識(shí)銜接過(guò)渡����。其次,下一專題學(xué)生將學(xué)習(xí)許多溶液中的反應(yīng)�����、強(qiáng)弱電解
5�����、質(zhì)概念�、離子反應(yīng)等知識(shí)。這些內(nèi)容均以電解質(zhì)和非電解質(zhì)的知識(shí)為基礎(chǔ)���,這也是專題1必須安排該內(nèi)容的原因����。在具體教學(xué)中可設(shè)計(jì)這樣的問(wèn)題引導(dǎo)過(guò)渡:氯化鈉���、蔗糖溶于水都能形成溶液����,它們?cè)谒械拇嬖谛问较嗤瑔幔克鼈兇嬖谛问降牟町悓?dǎo)致了其哪些性質(zhì)上的不同���?如何通過(guò)實(shí)驗(yàn)證明���?
化學(xué)學(xué)科中這些知識(shí)點(diǎn)之間并沒(méi)有一個(gè)嚴(yán)格的因果關(guān)系,它們也就未必存在一個(gè)認(rèn)知框架��,規(guī)定其必然的先后呈現(xiàn)順序����。專題1的組織線索較以往有較大的變化,全新面貌的演繹需要對(duì)化學(xué)學(xué)科的理解����。那些串接一個(gè)個(gè)知識(shí)點(diǎn)的化學(xué)思想與內(nèi)涵�,更需要教師用心揣摩,方能避免人為割裂本該凝為一體的知識(shí)體系�,讓學(xué)生從整體把握專題1看似紛繁的知識(shí)點(diǎn)背后的內(nèi)在聯(lián)系,實(shí)現(xiàn)其
6�、學(xué)科知識(shí)的體系化。
二�����、目標(biāo)分析
《課程標(biāo)準(zhǔn)》對(duì)本部分內(nèi)容的學(xué)習(xí)提出了如下要求。
(1)能根據(jù)物質(zhì)的組成和性質(zhì)對(duì)物質(zhì)進(jìn)行分類�。
(2)知道化學(xué)科學(xué)的主要研究對(duì)象,知道化學(xué)是在分子層次上認(rèn)識(shí)物質(zhì)和合成新物質(zhì)的一門科學(xué)���。
(3)了解物質(zhì)的組成�、結(jié)構(gòu)和性質(zhì)的關(guān)系�����;認(rèn)識(shí)化學(xué)變化的本質(zhì)���。
(4)認(rèn)識(shí)摩爾是物質(zhì)的量的基本單位����,能用于進(jìn)行簡(jiǎn)單的化學(xué)計(jì)算��,體會(huì)定量研究的方法對(duì)研究和學(xué)習(xí)化學(xué)的重要作用����。
根據(jù)《課程標(biāo)準(zhǔn)》,在教學(xué)過(guò)程中需要達(dá)到如下目標(biāo):
(1)初步認(rèn)識(shí)物質(zhì)的科學(xué)分類方法���,學(xué)會(huì)從不同角度(尤其是物質(zhì)的組成和性質(zhì)角度)對(duì)常見(jiàn)物質(zhì)進(jìn)行分類�����。
(2)掌握四種基本化學(xué)反應(yīng)類型���,能根據(jù)
7��、化合價(jià)的變化判斷是否為氧化還原反應(yīng)�。認(rèn)識(shí)化學(xué)反應(yīng)基本類型與氧化還原反應(yīng)之間的關(guān)系�。
(3)認(rèn)識(shí)物質(zhì)的量及其單位——摩爾的含義。
(4)理解物質(zhì)的量��、物質(zhì)的粒子數(shù)�、物質(zhì)的質(zhì)量、摩爾質(zhì)量之間的聯(lián)系��,能根據(jù)它們之間的關(guān)系進(jìn)行簡(jiǎn)單計(jì)算�����。
(5)理解用化學(xué)方程式表示反應(yīng)物和生成物之間物質(zhì)的量的關(guān)系����。
(6)知道不同聚集狀態(tài)物質(zhì)的一些特性,根據(jù)物質(zhì)的存在狀態(tài)進(jìn)行分類����,知道固、液�����、氣態(tài)物質(zhì)的一些特性����。
(7)了解影響氣體體積的主要因素,初步學(xué)會(huì)運(yùn)用氣體摩爾體積等概念進(jìn)行簡(jiǎn)單的計(jì)算��。
(8)了解分散系的含義�,知道膠體區(qū)別于其他分散系的本質(zhì)特征和鑒別方法。
(9)知道膠體是一種常見(jiàn)的分散系��,了解膠
8���、體的重要性質(zhì)和應(yīng)用�。
(10)知道電解質(zhì)和非電解質(zhì)���,初步學(xué)會(huì)書寫離子方程式�。
三、重難點(diǎn)分析
教材對(duì)難點(diǎn)進(jìn)行了分散安排��,將某些概念安排在不同模塊中逐步深化�,這種設(shè)置方式符合學(xué)生認(rèn)識(shí)水平螺旋式發(fā)展的特點(diǎn),有效地方病保護(hù)了學(xué)生學(xué)習(xí)化學(xué)的積極性�����。因此在教學(xué)中不宜采取一步到位的方法���。
1.對(duì)氧化還原反應(yīng)只要求學(xué)會(huì)判斷�,如果學(xué)生在初中沒(méi)有學(xué)習(xí)依據(jù)得失氧來(lái)判斷氧化還原反應(yīng)�����,不必特意增加這個(gè)判斷依據(jù)��。不要對(duì)其它概念(氧化反應(yīng)��、還原反應(yīng)�����、氧化劑���、還原劑等)進(jìn)行擴(kuò)展�,也不對(duì)復(fù)雜氧化還原反應(yīng)進(jìn)行配平���。相關(guān)內(nèi)容將在后續(xù)課程中學(xué)習(xí)���。
2.物質(zhì)的量是本單元的重難點(diǎn),但在教學(xué)中不應(yīng)對(duì)學(xué)生過(guò)多的強(qiáng)調(diào)其重要性����,以
9、免引起學(xué)生的恐懼心理�,重點(diǎn)在于知道物質(zhì)的量是基本物理量,并能利用物質(zhì)的量進(jìn)行簡(jiǎn)單計(jì)算����。不宜在概念上過(guò)多糾纏。
3.氣體摩爾體積的教學(xué)重點(diǎn)在于能進(jìn)行簡(jiǎn)單計(jì)算��,阿伏加德羅定律的推論不作要求�����。
4.對(duì)晶體和非晶體的結(jié)構(gòu)特點(diǎn)和性質(zhì)差異只作簡(jiǎn)單介紹��,或作為課外閱讀材料。
5.能判斷電解質(zhì)和非電解質(zhì)��,并書寫常見(jiàn)物質(zhì)的電離方程式����,但不要求區(qū)別強(qiáng)弱電解質(zhì),更不宜涉及離子反應(yīng)等內(nèi)容��。
6.膠體的概念只要求了解其不同于溶液的特性�����,對(duì)膠體的凝聚�����、布朗運(yùn)動(dòng)等不宜擴(kuò)展����。
四、實(shí)驗(yàn)研究
1.在演示氣溶膠的丁達(dá)爾現(xiàn)象時(shí)���,向一錐形瓶中滴入幾滴濃氨水���,用玻璃棒蘸取濃鹽酸伸入錐形瓶中����,使之形成煙即氣溶膠�,讓激光柱
10����、通過(guò)錐形瓶,對(duì)這些再進(jìn)行實(shí)物投影��,展現(xiàn)于銀幕����。激光是紅色的,通過(guò)白煙時(shí)的現(xiàn)象非常美麗����。
2.氫氧化鐵膠體溶液的制備,為了操作上的方便與快速����,在20mL煮沸的蒸餾水中加入2 ~3滴FeCl3飽和溶液,便得到清澈透明的紅褐色Fe(OH)3膠體�����,加入FeCl3的量不宜多,否則將生成Fe(OH)3沉淀���。
3.如果要增加明礬的凈水實(shí)驗(yàn)�,可以用這樣的配比:200mL渾濁的水中滴加10滴(0.5mL)飽和明礬溶液即可以達(dá)到理想的潔凈效果���。如果所加明礬太多���,酸度將增大,Al(OH)3膠體的量就不會(huì)很多����,潔凈水的效果反倒不好。
五����、教學(xué)建議
1.教材有豐富多彩的欄目設(shè)置,蘊(yùn)涵著教與學(xué)的方法���,體現(xiàn)了新課程
11���、的理念,能夠充分調(diào)動(dòng)教師教與學(xué)生學(xué)的積極性,教師可以充分開(kāi)發(fā)利用教材資源�。
2.整個(gè)單元的教學(xué)設(shè)計(jì)要圍繞“物質(zhì)”中心,從物質(zhì)的分類�、變化到物質(zhì)的處理(分離、提純及檢驗(yàn))再到物質(zhì)內(nèi)在結(jié)構(gòu)的研究����,從而使學(xué)生對(duì)“物質(zhì)”的整體知識(shí)有較為全面的了解����。
3.精心創(chuàng)設(shè)多種問(wèn)題情景:可來(lái)源于生活經(jīng)驗(yàn),如物質(zhì)聚集狀態(tài)��,同位素的應(yīng)用����;來(lái)源于生產(chǎn)實(shí)際,如自然界中存在的晶體��;來(lái)源于學(xué)生的學(xué)習(xí)�����,如對(duì)已有原子結(jié)構(gòu)的認(rèn)識(shí)��;來(lái)源于科學(xué)史料,如原子結(jié)構(gòu)模型的演變���,無(wú)機(jī)化合物轉(zhuǎn)變?yōu)橛袡C(jī)化合物的史料�。舉例要適當(dāng)�、典型,不宜選用學(xué)生不太熟悉的反應(yīng)實(shí)例���。注意與初中自然學(xué)科相關(guān)知識(shí)的銜接��,確保學(xué)生的可接受性�。
4.物質(zhì)的量概念中包含著微觀粒子的計(jì)量方法��,氣體摩爾體積中包含著氣體物質(zhì)的計(jì)量方法���,物質(zhì)的量和氣體摩爾體積等概念中還包含著有關(guān)化學(xué)計(jì)算的技能�����。教學(xué)設(shè)計(jì)中要注意這方面知識(shí)和技能目標(biāo)的把握�。
5.氣體摩爾體積教學(xué)中�,要充分運(yùn)用實(shí)物、圖片����、實(shí)例進(jìn)行分析����,使學(xué)生理解學(xué)習(xí)氣體摩爾體積的意義����。并能進(jìn)行簡(jiǎn)單的計(jì)算。
6.在教學(xué)中要注意階段學(xué)習(xí)目標(biāo)的達(dá)成����,嚴(yán)格控制教學(xué)深度、難度���,避免學(xué)生在剛開(kāi)始高中化學(xué)學(xué)習(xí)的時(shí)候就產(chǎn)生畏難情緒。
 2022年高中化學(xué) 《豐富多彩的化學(xué)物質(zhì)》教案1 蘇教版必修1
2022年高中化學(xué) 《豐富多彩的化學(xué)物質(zhì)》教案1 蘇教版必修1