《高考化學(xué)二輪復(fù)習(xí) 考前三個(gè)月 考前專項(xiàng)沖刺集訓(xùn) 第11題 電化學(xué)基礎(chǔ)》由會(huì)員分享����,可在線閱讀,更多相關(guān)《高考化學(xué)二輪復(fù)習(xí) 考前三個(gè)月 考前專項(xiàng)沖刺集訓(xùn) 第11題 電化學(xué)基礎(chǔ)(5頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�。
1、第11題 電化學(xué)基礎(chǔ)
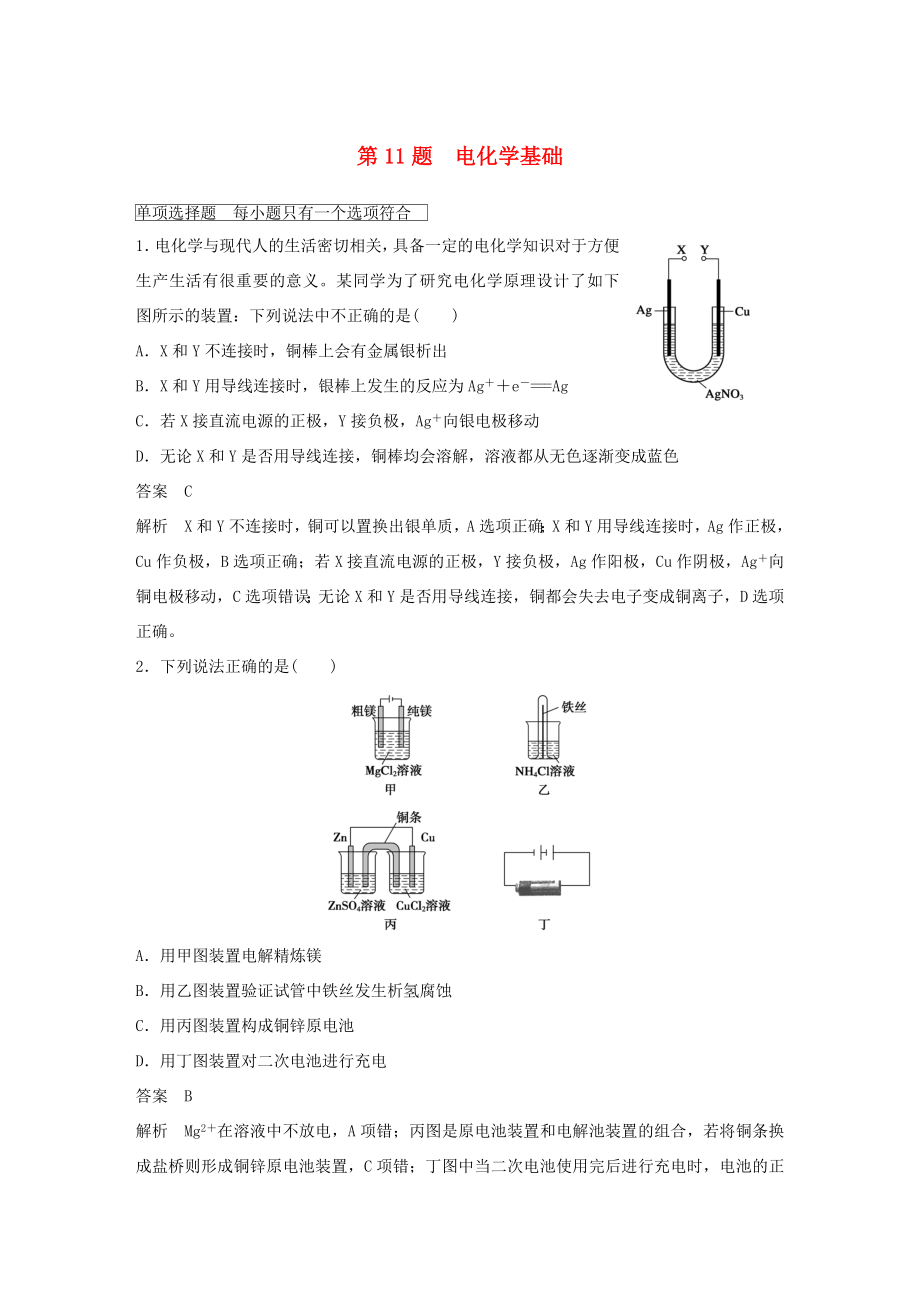
1.電化學(xué)與現(xiàn)代人的生活密切相關(guān)��,具備一定的電化學(xué)知識(shí)對(duì)于方便生產(chǎn)生活有很重要的意義�����。某同學(xué)為了研究電化學(xué)原理設(shè)計(jì)了如下圖所示的裝置:下列說(shuō)法中不正確的是( )
A.X和Y不連接時(shí)�����,銅棒上會(huì)有金屬銀析出
B.X和Y用導(dǎo)線連接時(shí)���,銀棒上發(fā)生的反應(yīng)為Ag++e-===Ag
C.若X接直流電源的正極�,Y接負(fù)極,Ag+向銀電極移動(dòng)
D.無(wú)論X和Y是否用導(dǎo)線連接���,銅棒均會(huì)溶解���,溶液都從無(wú)色逐漸變成藍(lán)色
答案 C
解析 X和Y不連接時(shí),銅可以置換出銀單質(zhì)���,A選項(xiàng)正確����;X和Y用導(dǎo)線連接時(shí)�����,Ag作正極���,Cu作負(fù)極��,B選項(xiàng)正確����;若X接直流電源的正極,Y接負(fù)極�,Ag作陽(yáng)極
2、����,Cu作陰極���,Ag+向銅電極移動(dòng)�,C選項(xiàng)錯(cuò)誤���;無(wú)論X和Y是否用導(dǎo)線連接��,銅都會(huì)失去電子變成銅離子��,D選項(xiàng)正確�。
2.下列說(shuō)法正確的是( )
A.用甲圖裝置電解精煉鎂
B.用乙圖裝置驗(yàn)證試管中鐵絲發(fā)生析氫腐蝕
C.用丙圖裝置構(gòu)成銅鋅原電池
D.用丁圖裝置對(duì)二次電池進(jìn)行充電
答案 B
解析 Mg2+在溶液中不放電����,A項(xiàng)錯(cuò);丙圖是原電池裝置和電解池裝置的組合��,若將銅條換成鹽橋則形成銅鋅原電池裝置��,C項(xiàng)錯(cuò);丁圖中當(dāng)二次電池使用完后進(jìn)行充電時(shí)��,電池的正極應(yīng)與外電源的正極相連���,D項(xiàng)錯(cuò)�����。
3.電化學(xué)在日常生活中用途廣泛�,下圖是鎂—次氯酸鈉燃料電池���,電池總反應(yīng)為Mg+ClO-+H2O
3�、===Cl-+Mg(OH)2↓�,下列說(shuō)法不正確的是( )
A.鎂電極是該電池的負(fù)極
B.惰性電極上發(fā)生氧化反應(yīng)
C.正極反應(yīng)式為ClO-+H2O+2e-===Cl-+2OH-
D.進(jìn)料口加入NaClO溶液,出口為NaCl溶液
答案 B
解析 根據(jù)方程式知Mg是還原劑作負(fù)極���,ClO-在惰性電極上得電子發(fā)生還原反應(yīng)�����,生成Cl-��。
4.如圖所示��,甲池的總反應(yīng)式為N2H4+O2===N2+2H2O
下列關(guān)于該電池工作時(shí)說(shuō)法正確的是( )
A.甲池中負(fù)極反應(yīng)為N2H4-4e-===N2+4H+
B.甲池溶液pH不變�,乙池溶液pH減小
C.甲池中消耗2.24 L O2,此
4�、時(shí)乙池中理論上最多產(chǎn)生12.8 g固體
D.反應(yīng)一段時(shí)間后,向乙池中加一定量CuO固體����,能使CuSO4溶液恢復(fù)到原濃度
答案 D
解析 A項(xiàng),甲池中原電池反應(yīng)��,對(duì)應(yīng)的電極反應(yīng)式是:正極O2+4e-+2H2O===4OH-���,負(fù)極N2H4-4e-+4OH-===N2+4H2O,錯(cuò)誤����;B項(xiàng),甲池中因反應(yīng)生成了水會(huì)使溶液的pH值減小��,乙池中因反應(yīng)生成了酸也會(huì)使溶液的pH值減小�����,錯(cuò)誤����;C項(xiàng)��,消耗氣體的體積沒(méi)有指明是否處于標(biāo)況�,無(wú)法計(jì)算����,錯(cuò)誤;D項(xiàng)�����,乙池發(fā)生的是電解池反應(yīng)�,兩極析出的分別是Cu和O2,因而加CuO后溶液能夠復(fù)原�����,正確���。
5.一種光化學(xué)電池的結(jié)構(gòu)如下圖����,當(dāng)光照在表面涂有氯化銀的銀片上
5��、時(shí),AgCl(s)Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化銀表面]�����,接著Cl(AgCl)+e-―→Cl-(aq)�����,若將光源移除�,電池會(huì)立即回復(fù)至初始狀態(tài)。下列說(shuō)法正確的是( )
A.光照時(shí)����,電流由Y流向X
B.光照時(shí)����,Pt電極發(fā)生的反應(yīng)為2Cl-+2e-===Cl2
C.光照時(shí),Cl-向Ag電極移動(dòng)
D.光照時(shí)�,電池總反應(yīng)為AgCl(s)+Cu+(aq)Ag(s)+Cu2+(aq)+Cl-
答案 D
解析 由題意,光照時(shí)��,Cl原子在Ag極得到電子形成Cl-��,Cl-由Ag極向Pt極遷移����,電子來(lái)源于Pt極上的Cu+失去的電子���,經(jīng)導(dǎo)線流入Ag極,光照
6���、時(shí)電流的方向與電子的流向相反��,綜上分析��,A�、B����、C錯(cuò)誤,D項(xiàng)正確����。
6.用Na2SO3溶液吸收硫酸工業(yè)尾氣中的二氧化硫,將所得的混合液進(jìn)行電解循環(huán)再生�����,這種新工藝叫再生循環(huán)脫硫法�����。其中陰、陽(yáng)離子交換膜組合循環(huán)再生機(jī)理如圖所示���,則下列有關(guān)說(shuō)法中不正確的是( )
A.X為直流電源的負(fù)極���,Y為直流電源的正極
B.陽(yáng)極區(qū)pH增大
C.圖中的b>a
D.該過(guò)程中的產(chǎn)品主要為H2SO4和H2
答案 B
解析 A項(xiàng),氫氣在Pt(Ⅰ)極上生成����,說(shuō)明Pt(Ⅰ)為陰極,則X為負(fù)極���,Y為正極����,正確���;B項(xiàng),陽(yáng)極區(qū)的SO��、HSO在陽(yáng)極被氧化為SO�����、H2SO4,酸性增強(qiáng)�����,pH減小��,錯(cuò)誤�;C項(xiàng),由于陰�、
7、陽(yáng)離子交換膜的存在��,使加進(jìn)陽(yáng)極區(qū)的硫酸的濃度小于陽(yáng)極再生的硫酸的濃度���,即b>a���,正確;D項(xiàng)����,陽(yáng)極產(chǎn)品為硫酸,陰極產(chǎn)品有氫氣和亞硫酸鈉,正確��。
7.納米Cu2O是一種用途廣泛的光電材料�,可用如圖所示的兩種電化學(xué)裝置制備,下列有關(guān)說(shuō)法正確的是( )
A.陽(yáng)極的電極反應(yīng)式均為2Cu-2e-+2OH-===Cu2O+H2O
B.工作過(guò)程中兩個(gè)裝置內(nèi)溶液的pH均減小
C.兩個(gè)裝置內(nèi)陰離子均移向銅電極
D.開(kāi)始時(shí)陰極上均有氫氣生成
答案 C
解析 為得到純凈的Cu2O���,Cu2O應(yīng)在銅電極上生成��,銅為陽(yáng)極�,陰離子移向陽(yáng)極���,C正確�����;右側(cè)裝置銅電極上的反應(yīng)式為2Cu-2e-+H2O===Cu
8�����、2O+2H+����,A錯(cuò)誤����;左側(cè)鐵電極上H+放電,總反應(yīng)式為2Cu+H2OCu2O+H2↑�����,水被消耗導(dǎo)致NaOH濃度增大�,pH增大,B錯(cuò)誤���;右側(cè)裝置開(kāi)始時(shí)是Cu2+在陰極放電�,D錯(cuò)誤�����。
8.下圖是將SO2轉(zhuǎn)化為重要的化工原料H2SO4的原理示意圖�����,下列說(shuō)法不正確的是( )
A.該裝置將化學(xué)能轉(zhuǎn)化為電能
B.電極b表面O2發(fā)生還原反應(yīng)�����,其附近酸性增強(qiáng)
C.電極a表面的反應(yīng)是SO2+2H2O-2e-===SO+4H+
D.若得到的硫酸濃度仍為49%�����,則理論上參加反應(yīng)的SO2與加入的H2O的質(zhì)量比為8∶15
答案 B
解析 該裝置為原電池
負(fù)極(a)2SO2-4e-+4H2O===8
9、H++2SO
正極(b)O2+4e-+4H+===2H2O�����,A項(xiàng)正確�����;
B項(xiàng)�,酸性應(yīng)減弱,錯(cuò)誤��;C項(xiàng)正確���;D項(xiàng)��,2SO2+O2+2H2O===2H2SO4����,n(H2SO4)==0.5 mol�����,
==,正確�����。
9.1807年化學(xué)家戴維用電解熔融氫氧化鈉的方法制得鈉:4NaOH(熔融)4Na+O2↑+2H2O�;后來(lái)蓋·呂薩克用鐵與熔融氫氧化鈉作用也制得鈉���,反應(yīng)原理為3Fe+4NaOH2H2↑+Fe3O4+4Na↑���。下列有關(guān)說(shuō)法中正確的是( )
A.電解熔融氫氧化鈉制鈉,陽(yáng)極上發(fā)生的電極反應(yīng)為2OH--2e-===H2↑+O2↑
B.蓋·呂薩克法制鈉原理是利用鐵的還原性比鈉強(qiáng)
C.若戴維法與蓋·呂薩克法制得等量的鈉�����,則兩反應(yīng)中轉(zhuǎn)移的電子總數(shù)相同
D.
目前常用電解熔融氯化鈉的方法制鈉(如圖)���,電解槽中石墨為陽(yáng)極����,鐵為陰極
答案 D
解析 由電解熔融NaOH的總反應(yīng)式知����,陽(yáng)極上發(fā)生的反應(yīng)為4OH--e-===2H2O+O2↑�����,A錯(cuò)���;鐵的還原性比鈉弱,該反應(yīng)的發(fā)生是利用平衡移動(dòng)原理(鈉的沸點(diǎn)低���,形成氣體而脫離反應(yīng)體系)�,B錯(cuò)��;由兩個(gè)反應(yīng)方程式知轉(zhuǎn)移的電子數(shù)不相等�,C錯(cuò)。
 高考化學(xué)二輪復(fù)習(xí) 考前三個(gè)月 考前專項(xiàng)沖刺集訓(xùn) 第11題 電化學(xué)基礎(chǔ)
高考化學(xué)二輪復(fù)習(xí) 考前三個(gè)月 考前專項(xiàng)沖刺集訓(xùn) 第11題 電化學(xué)基礎(chǔ)