《2022年中考化學(xué)一輪復(fù)習(xí) 4.3離子復(fù)習(xí)學(xué)案 人教新課標(biāo)版》由會員分享��,可在線閱讀���,更多相關(guān)《2022年中考化學(xué)一輪復(fù)習(xí) 4.3離子復(fù)習(xí)學(xué)案 人教新課標(biāo)版(2頁珍藏版)》請在裝配圖網(wǎng)上搜索��。
1�、2022年中考化學(xué)一輪復(fù)習(xí) 4.3離子復(fù)習(xí)學(xué)案 人教新課標(biāo)版
一��、學(xué)習(xí)目標(biāo):
1����、知道原子核外的電子是分層排布的,知道原子結(jié)構(gòu)的表示方法��,會畫1-18號元素的原子結(jié)構(gòu)示意圖���。
2��、知道原子結(jié)構(gòu)與元素化學(xué)性質(zhì)的關(guān)系�。
3�、知道離子的形成過程,會用離子符號正確的表示離子���。
二、自主探究
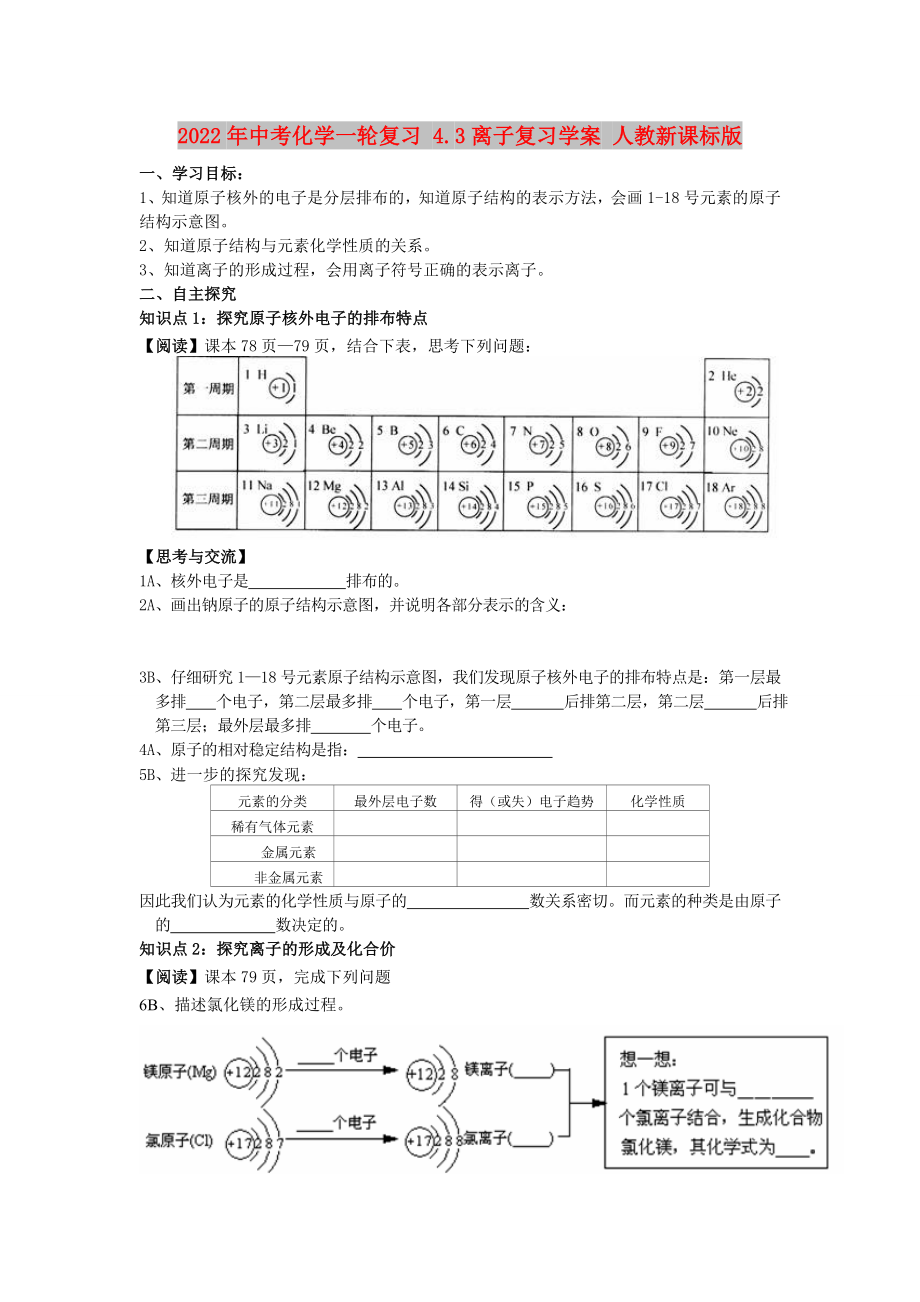
知識點1:探究原子核外電子的排布特點
【閱讀】課本78頁—79頁��,結(jié)合下表�����,思考下列問題:
【思考與交流】
1A、核外電子是 排布的���。
2A���、畫出鈉原子的原子結(jié)構(gòu)示意圖,并說明各部分表示的含義:
3B�、仔細(xì)研究1—18號元素原子結(jié)構(gòu)示意圖,我們發(fā)現(xiàn)原子核外電
2�����、子的排布特點是:第一層最多排 個電子��,第二層最多排 個電子���,第一層 后排第二層�����,第二層 后排第三層�;最外層最多排 個電子。
4A����、原子的相對穩(wěn)定結(jié)構(gòu)是指:
5B、進(jìn)一步的探究發(fā)現(xiàn):
元素的分類
最外層電子數(shù)
得(或失)電子趨勢
化學(xué)性質(zhì)
稀有氣體元素
金屬元素
非金屬元素
因此我們認(rèn)為元素的化學(xué)性質(zhì)與原子的 數(shù)關(guān)系密切�。而元素的種類是由原子的 數(shù)決定的。
知識點2:探究離子的形成
3��、及化合價
【閱讀】課本79頁����,完成下列問題
6B、描述氯化鎂的形成過程�����。
【思考與交流】
7B���、關(guān)于離子的形成及化合價�����,我的看法是:
原子 →陽離子→帶正電 →顯正價
原子 →陰離子→帶 →顯
8A����、離子:帶電的 或 叫離子��。帶正電的離子叫 ���;帶負(fù)電的離子叫 ��。
9C�、我認(rèn)為離子與化合價的表示方法分別是:
10D����、填空:
?
【反思與小結(jié)】關(guān)于離子與化合價我得出了以下結(jié)論:
11B、(1) 化合物里各元素的化合價的代數(shù)和為
4���、
(2)元素在化合物里顯示正價或負(fù)價�,形成單質(zhì)時顯 價
三��、自我測評
12A�����、課本80頁習(xí)題第1題
13A ����、構(gòu)成物質(zhì)的基本微粒有三種,它們是 、 和 �。金屬單質(zhì)鐵由 直接構(gòu)成,氦氣由 直接構(gòu)成���。非金屬氣體單質(zhì)如H2是由 直接構(gòu)成的����。氯化鈉是由 構(gòu)成的���。
14B�����、寫出下列符號的意義
?2 O_____________ N ??Fe2+ SO42-
15B���、用下面結(jié)構(gòu)示意圖的字母填空
?
?
?
(1)屬于金屬原子的是_________,(2)具有穩(wěn)定結(jié)構(gòu)的是_________����。
16C、寫出鋁離子����、鎂離子����、鐵離子���、亞鐵離子的符號和化合價表示方法
17D、填寫下表
名 稱
銨 根
硝酸根
氫氧根
硫酸根
碳酸根
磷酸根
符 號
NH4
NO3
OH
SO4
CO3
PO4
用離子符號表示
用化合價表示
?
 2022年中考化學(xué)一輪復(fù)習(xí) 4.3離子復(fù)習(xí)學(xué)案 人教新課標(biāo)版
2022年中考化學(xué)一輪復(fù)習(xí) 4.3離子復(fù)習(xí)學(xué)案 人教新課標(biāo)版