《2022年高二化學(xué)《電能轉(zhuǎn)化為化學(xué)能--電解》教案2》由會(huì)員分享�,可在線閱讀,更多相關(guān)《2022年高二化學(xué)《電能轉(zhuǎn)化為化學(xué)能--電解》教案2(5頁珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�。
1、2022年高二化學(xué)《電能轉(zhuǎn)化為化學(xué)能--電解》教案2
【教學(xué)目標(biāo)】
1����、 了解電解原理在生產(chǎn)中的應(yīng)用。
2�����、 了解電解、電鍍和電解精煉之間的區(qū)別和聯(lián)系���。
【教學(xué)重點(diǎn)】電解原理的應(yīng)用�����;判斷非惰性材料的電極反應(yīng)�����;離子(金屬電極)的放電順序�����;
【教學(xué)難點(diǎn)】電解過程中電解質(zhì)溶液中離子濃度的變化����;初步學(xué)會(huì)運(yùn)用化學(xué)原理分析解決工業(yè)生產(chǎn)實(shí)際問題的能力和方法�����。
【教學(xué)過程設(shè)計(jì)】
教師活動(dòng)
學(xué)生活動(dòng)
設(shè)計(jì)意圖?
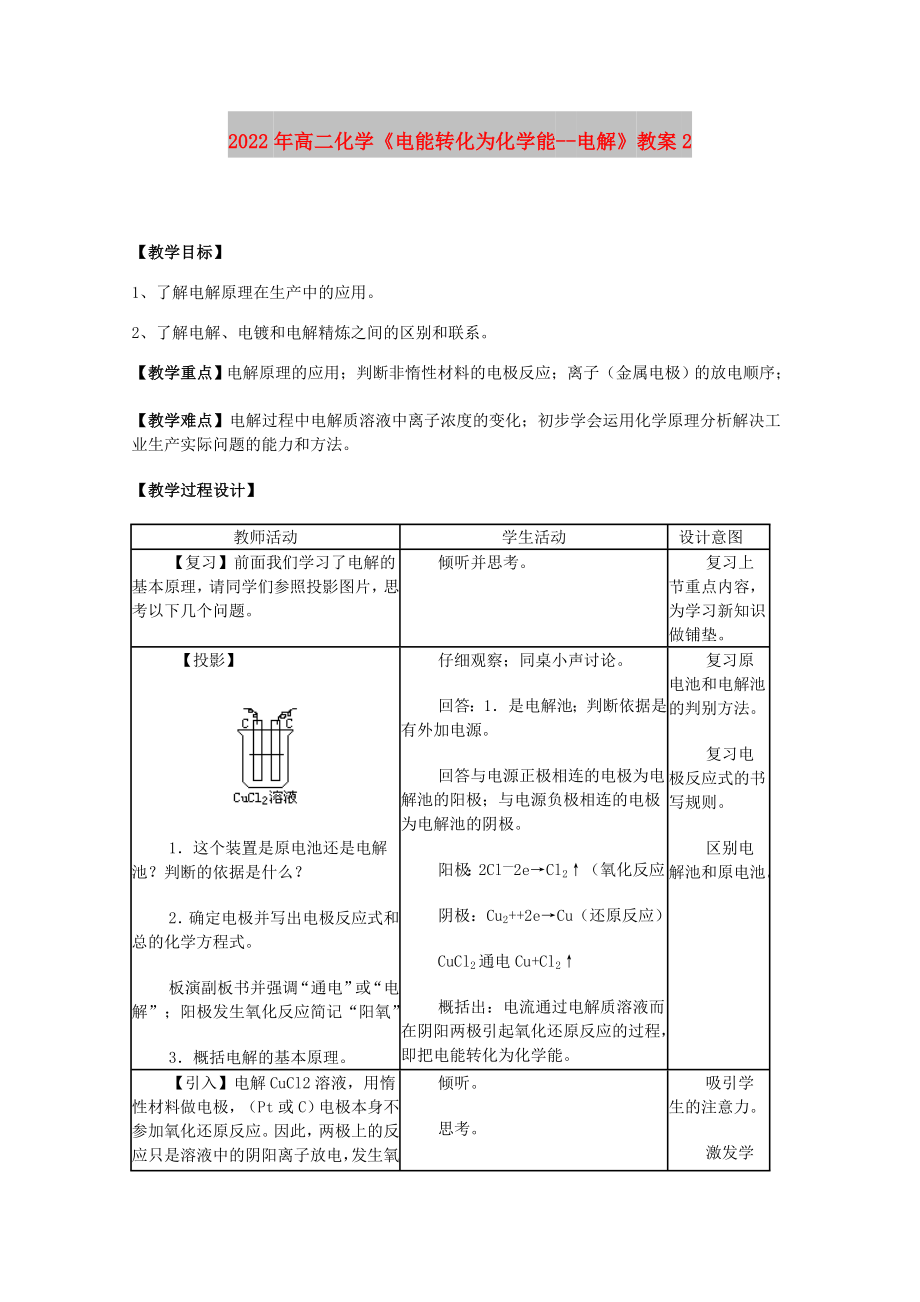
【復(fù)習(xí)】前面我們學(xué)習(xí)了電解的基本原理�,請(qǐng)同學(xué)們參照投影圖片���,思考以下幾個(gè)問題。
傾聽并思考�����。
復(fù)習(xí)上節(jié)重點(diǎn)內(nèi)容�,為學(xué)習(xí)新知識(shí)做鋪墊。
【投影】
1.這個(gè)裝置是原
2�����、電池還是電解池�?判斷的依據(jù)是什么���?
2.確定電極并寫出電極反應(yīng)式和總的化學(xué)方程式�。
板演副板書并強(qiáng)調(diào)“通電”或“電解”�����;陽極發(fā)生氧化反應(yīng)簡(jiǎn)記“陽氧”
3.概括電解的基本原理����。
仔細(xì)觀察����;同桌小聲討論�����。
回答:1.是電解池�����;判斷依據(jù)是有外加電源����。
回答與電源正極相連的電極為電解池的陽極;與電源負(fù)極相連的電極為電解池的陰極���。
陽極:2Cl—2e→Cl2↑(氧化反應(yīng))
陰極:Cu2++2e→Cu(還原反應(yīng))
CuCl2通電Cu+Cl2↑
概括出:電流通過電解質(zhì)溶液而在陰陽兩極引起氧化還原反應(yīng)的過程���,即把電能轉(zhuǎn)化為化學(xué)能。
復(fù)習(xí)原電池和電解池的判別方法����。
復(fù)習(xí)電極反應(yīng)式的書寫規(guī)
3、則�。
區(qū)別電解池和原電池����。
【引入】電解CuCl2溶液����,用惰性材料做電極,(Pt或C)電極本身不參加氧化還原反應(yīng)����。因此,兩極上的反應(yīng)只是溶液中的陰陽離子放電���,發(fā)生氧化還原反應(yīng)���。
【設(shè)問】若將兩個(gè)電極換成活潑材料的電極,情況將會(huì)怎樣呢����?
【板書】二�、電解原理的應(yīng)用
電解食鹽水
【投影實(shí)驗(yàn)】
【引導(dǎo)】1.觀察要點(diǎn):(1)陰極上的現(xiàn)象
(2)陽極上的現(xiàn)象
(3)陰極區(qū)溶液中的現(xiàn)象
2.能使?jié)駶?rùn)的淀粉-KI試紙變藍(lán)的氣體,應(yīng)是學(xué)過的什么氣體�����?
傾聽。
思考�。
仔細(xì)思考觀察出:Fe為陰極,C棒為陽極�����。
吸引學(xué)生的注意力�����。
激發(fā)學(xué)習(xí)興趣和好奇心���,促進(jìn)進(jìn)一步思考���。
確定電
4、極產(chǎn)物���,培養(yǎng)觀察能力和口頭表達(dá)能力�����。
【提問】請(qǐng)描述實(shí)驗(yàn)現(xiàn)象����,試判斷出結(jié)論。
【板演】
通電前:NaCl=Na++Cl-
通電后:陰極(Fe):Na+�、H+移向陰極
2H++2e=H2↑(還原反應(yīng))
陽極(C):Cl-、OH-移向陽極
2Cl--2e=Cl2↑(氧化反應(yīng))
【提問】陰極區(qū)附近酚酞試劑變紅是什么原因�?
【追問】是什么堿?
【小結(jié)】在陰極:由于2H++2e=H2↑�,H+不斷被消耗,促進(jìn)H2O=H++OH-向右移動(dòng)�,破壞了水的電離平衡,[OH-]的濃度相對(duì)地增大了���,因此�����,在陰極附近形成了氫氧化鈉溶液����。
【提問】總的電解化學(xué)方程式怎么寫����?
【板演】2NaCl
5���、+2H2O=H2+Cl2↑+2NaOH
【追問】這樣寫是否正確�����?
【講解】工業(yè)上就是應(yīng)用電解食鹽水溶液的方法制取燒堿和氯氣�。
【板書】1.電解食鹽水制取氯氣和燒堿。
【講解】目前���,我國工業(yè)上大多采用立式隔膜電解槽電解食鹽水溶液制取氯氣和燒堿�����。請(qǐng)同學(xué)們打開課本第60頁自學(xué)閱讀材料�����。
回答現(xiàn)象與結(jié)論:
1.陰極上有氣泡���。
2.陽極有刺激性氣味氣體產(chǎn)生,能使?jié)櫇竦牡矸?KI試紙變藍(lán)����;應(yīng)是Cl2。
3.陰極區(qū)附近溶液變紅����,有堿產(chǎn)生�����。
金屬鐵做陰極�����,不參加反應(yīng)����。
陽極發(fā)生氧化反應(yīng)���。
閱讀課本第14頁,看后相互討論�����,推選代表回答:
陰極區(qū)附近有堿生成�,NaOH����。
6、回答:
2NaCl+2H2O=H2↑+Cl2↑+2NaOH
(1)未配平���。
(2)反應(yīng)條件應(yīng)寫通電或電解���。
閱讀、記重點(diǎn)號(hào)�����。
1.電極材料�����;陽極:金屬鈦或石墨�;陰極:鐵絲網(wǎng)。
2.隔膜作用:把電解槽隔成陽極室和陰極室����;阻止氣體分子穿過,防止H2和Cl2混合爆炸����,避免Cl2和NaOH反應(yīng)。
3.凈制:除去Mg2+和Cu2+�、SO42-。防止Mg(OH)2之類的不溶性雜質(zhì)堵塞隔膜孔隙����。
4.H2由陰極室上邊導(dǎo)管放出�;Cl2由陽極室上邊導(dǎo)管放出�。
確定兩極上的反應(yīng)。培養(yǎng)概括�、分析能力,正確書寫電極反應(yīng)式�����。
知識(shí)再現(xiàn)���,強(qiáng)調(diào)分析電解原理的一般步驟�����,培養(yǎng)分析方法���。與第一課時(shí)相呼應(yīng)。強(qiáng)化
7����、概念和基礎(chǔ)知識(shí)。
充分發(fā)揮學(xué)生的主觀因素���,使他們成為學(xué)習(xí)的主體�,問題設(shè)計(jì)有梯度,便于不同層次學(xué)生思考�����,相互討論培養(yǎng)合作精神���。
正確書寫電解的總的化學(xué)方程式。
培養(yǎng)自學(xué)能力�����,創(chuàng)設(shè)新型學(xué)習(xí)氛圍����,養(yǎng)成閱讀、看書����、小結(jié)的良好習(xí)慣和方法,進(jìn)行理論聯(lián)系實(shí)際的教育�。
【講解】利用電解原理,還可以精煉銅和電鍍等�����。
【板書】2.銅的電解精煉。
【板演】
陽極:Cu - 2e- = Cu2+(氧化反應(yīng))
陰極:Cu2+ + 2e- = Cu(還原反應(yīng))
作為陽極的粗銅不斷溶解���,銅在陰極上不斷析出���,結(jié)果使粗銅變成了精銅
閱讀課本第17頁2。
2. 電極反應(yīng)式
陽極:Cu - 2e- =
8����、 Cu2+(氧化反應(yīng))
陰極:Cu2+ + 2e- = Cu(還原反應(yīng))
了解電解槽的簡(jiǎn)單結(jié)構(gòu)。
了解冶煉銅的原料����。
正確書寫電極反應(yīng)式和總的化學(xué)方程式。
【演示】
【板書】3.電鍍:利用電解原理在某些金屬表面鍍上一薄層金屬或合金的過程���,金屬叫鍍件�����,薄層叫鍍層�����。
【板演】陽極Zn���、CI-
【設(shè)問】誰先放電����?
【板演】Zn - 2e- = Zn2+(氧化反應(yīng))
陰極Fe�、Zn2+
【設(shè)問】誰先放電?
Zn2+ + 2e- = Zn (還原反應(yīng))
【設(shè)疑】
在陽極 Zn-2e=Zn2+
在陰極Zn2++2e=Zn
觀察:
1.Fe板上有一層
9�����、銀白色物質(zhì)�����。
2.Zn板上變化不明顯���。
分析:
陽極:Zn、CI-
Zn-2e=Zn2+(氧化反應(yīng))
概括出:陽極
(1)金屬放電能力>陰離子����。
(2)金屬做陽極時(shí)首先放電。電極參加反應(yīng)���。
培養(yǎng)觀察能力�����。
培養(yǎng)概括能力����。
Zn做陽極時(shí)的放電順序:Zn>Cl-
概括:弄清非惰性材料作電極的放電順序。
電鍍過程中電解質(zhì)離子的濃度不變����。
溶液中的[Zn2+]是否改變?
【講解】在上面的實(shí)驗(yàn)中�����,F(xiàn)e板是鍍件����,Zn是鍍層金屬,用ZnCl2作電鍍液����。
【設(shè)疑】如果想在Fe板上鍍銅,請(qǐng)分析鍍件是什么?鍍層金屬是什么���?電鍍液應(yīng)選用什么化合物�?
【小結(jié)】電鍍時(shí)應(yīng)選用
【板書】陰
10�����、極:鍍件→待鍍金屬
陽極:鍍層金屬
電鍍液:含有鍍層金屬離子的溶液�。
【講解】請(qǐng)打開課本第16頁閱讀最后一段。
思考:[Zn2+]不發(fā)生改變�。
討論得出結(jié)論:
1.鍍件:Fe板
2.鍍層金屬:Cu
3.電鍍液:CuCl2溶液。
閱讀����。
培養(yǎng)創(chuàng)新精神和概括能力����。
?
?
?
?
?
?
了解電鍍工業(yè)的發(fā)展簡(jiǎn)況。
【課堂練習(xí)】
【投影】1.寫出下列電極反應(yīng)式:
①電解水(Pt作電極)制氫氣和氧氣(加入少量的H2SO4或NaOH稀溶液)�。
②電解熔融MgCl2制金屬鎂(C棒做電極)。
討論做練習(xí)并向教師詢問����。
復(fù)習(xí)惰性電極不參加反應(yīng)和離子放電順序。練習(xí)電解池的兩極判別方法。非惰性材料作電極時(shí)的電極反應(yīng)���,了解提煉銅的電極反應(yīng)�����。
?
 2022年高二化學(xué)《電能轉(zhuǎn)化為化學(xué)能--電解》教案2
2022年高二化學(xué)《電能轉(zhuǎn)化為化學(xué)能--電解》教案2